Chapitres
- 01. Introduction : l'atome, le premier composant de la molécule
- 02. Atome et molécule
- 03. La molécule et sa formule
- 04. Déterminer la géométrie d'une molécule
- 05. La représentation de Cram
- 06. Géométrie de molécules simples
- 07. Géométrie des molécules : le méthane
- 08. Géométrie des molécules : l'ammoniac
- 09. Géométrie des molécules : l'eau
- 10. Géométrie des molécules : la méthode VSEPR
- 11. Exemple de géométrie d’une molécule connue : le dioxyde de carbone
- 12. Connaître la polarisation d'une molécule
- 13. Les liaisons entre atomes au sein d'une molécule
- 14. Les forces de Van Der Waals au sein d'une molécule

Introduction : l'atome, le premier composant de la molécule

Un élément chimique (ou élément) est un ensemble d'atomes qui ont le même nombre de protons dans leur noyau. Ce nombre est le numéro atomique de l'élément. Ce terme désigne également une substance pure constituée d'atomes ayant le même nombre de protons. Un élément chimique peut se transformer en un autre élément par une réaction nucléaire. Cette définition moderne fut introduite par Robert Boyle en 1661. En effet, une réaction chimique met en jeu les liens entre les électrons externes des atomes, alors qu'une réaction nucléaire modifie les nucléons du noyau atomique. Chaque atome a des propriétés chimiques différentes qui dépendent directement du nombre atomique. Ces éléments sont répertoriés dans un tableau périodique inventé par Mendeleïev et nommé le tableau périodique des éléments. On en connait actuellement 117 (de 1 à 118 excepté le 117) dont 94 présents à l'état naturel sur Terre.
Le terme de réaction nucléaire désigne la transformation d'un ou plusieurs noyaux atomiques. Une réaction chimique, au contraire, concerne uniquement les électrons ou les liaisons entre les atomes.
Dans une réaction nucléaire, deux noyaux atomiques entrent en collision ; les produits résultants de cette collision sont différents des particules originelles. Dans le cas de la radioactivité, la transformation est spontanée, mais dans le cas d'une réaction nucléaire, elle est produite par une particule mouvante. Si les particules se séparent après la collision sans être transformées, le processus n'est pas une réaction, mais une collision élastique.
L'atome
L'atome a une structure particulière, les scientifiques sont passés par différents stades avant d'arriver à décrire celle-ci. Le noyau d'un atome est constitué de protons et de neutrons, il est donc électriquement positif. Ce noyau est entouré d'électrons qui gravitent autour de celui-ci, la partie la plus extérieure de l'atome est donc électriquement positif. Dans le cas d'un atome, ces deux parties électriques se compensent et donnent un atome électriquement neutre, ce n'est pas forcément le cas pour les ions. Ces deux parties sont séparées par du vide. En effet, on dit souvent de l'atome qu'il a une structure lacunaire. De plus, la taille du noyau est très petite comparé à celle de l'atome entier.
Imaginez un banc de sable vu de loin, on ne peut pas distinguer les grains qui le constitue. On peut les voir seulement en s'approchant de très près.
La matière qui nous entoure est également constituée de petits grains de matière appelés atomes, ils ne peuvent être observés ni à l'œil nu, ni avec les microscopes optiques conventionnels.
Comme il existe plus d'une centaine d'atomes différents, on attribue un symbole à chaque atome de même nature. Il commence toujours par une lettre majuscule suivie parfois d'une lettre minuscule.
Pour mieux visualiser ces atomes invisibles à notre œil, on utilise souvent un modèle qui représente les atomes courants sous la forme de boules colorées, à chaque atome correspond une couleur.
| Atome | Symbole | Couleur |
|---|---|---|
| Carbone | C | Noir |
| Hydrogène | H | Blanc |
| Oxygène | O | Rouge |
| Chlore | Cl | Vert |
| Azote | N | Bleu |
| Soufre | S | Jaune |
| Phosphore | P | Violet |
| Fer | Fe | Gris |
Transformations subies par les atomes
Lorsque les atomes subissent des transformations (transformation en ion monoatomique ou lorsque qu'ils établissent des liaisons avec d'autres atomes) ils le font de façon à saturer leur couche externe.
Atomes chimiquement stables
Les atomes dont la couche externe est déjà saturée ne donneront donc pas d'ion monoatomique et n'auront pas tendance à établir de liaison avec d'autres atomes. Ils sont dits "chimiquement stables". On dit aussi qu'ils présentent une grande inertie chimique.
Règle du duet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z < 4 évoluent de manière à saturer leur couche (K). Ils acquièrent un "duet" d'électrons c'est-à-dire une paire d'électrons.
Règle de l'octet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z > 4 évoluent de manière à saturer leur couche externe (L) ou (M) etc... Ils acquièrent un "octet" d'électrons c'est-à-dire 8 électrons ou 4 paires d'électrons.
Il existe des exceptions à la règle de l'octet. Ces exceptions ne sont pas étudiées dans le cadre du cours de seconde.
Prévision de la charge des ions monoatomiques.
L'application de ces règles permettent de prévoir la charge et donc la formule de la plupart des ions monoatomiques.
Par exemple : Considérons l'atome de chlore de numéro atomique Z=17 dont la formule électronique est: (K)2(L)8(M)7. Il possède 7 électrons sur sa couche externe (M). En se transformant en ion chlorure il sature cette couche externe avec un octet (8) électrons. Cet atome, initialement neutre du point de vue électrique, va donc gagner un électron c'est-à-dire une charge négative lors de sa transformation en ion chlorure. La formule de cet ion est alors: Cl-.
Défaut de masse d'un noyau et énergie de liaison d'un noyau
L’atome a une structure particulière, les scientifiques sont passés par différents stades avant d’arriver à décrire celle-ci. Le noyau d’un atome est constitué de protons et de neutrons, il est donc électriquement positif. Ce noyau est entouré d’électrons qui gravitent autour de celui-ci, la partie la plus extérieure de l’atome est donc électriquement négatif. Dans le cas d’un atome, ces deux parties électriques se compensent et donnent un atome électriquement neutre, ce n’est pas forcément le cas pour les ions. Ces deux parties sont séparées par du vide. En effet, on dit souvent de l’atome qu’il a une structure lacunaire. De plus, la taille du noyau est très petite comparé à celle de l’atome entier.
Défaut de masse d'un noyau
La masse d'un noyau est inférieure à la somme des masses des particules qui le composent. Le défaut de masse est cette différence. Elle est positive.
Défaut de masse :
[ Delta m = Z times m _ { p } + left( A - Z right) times m _ { n } - m _ { text { noyau } } ]
Energie de liaison
Relation d'Einstein
Le principe d'équivalence (1905), énergie-masse sont deux grandeurs proportionnelles et que de la masse peut se convertir en énergie et inversement. Toutes particules possèdent du fait de sa masse une énergie potentielle de repos.
[ E = m times c ^ { 2 } ]
Energie de liaison
Elle est définie comme étant l'énergie qu'il faut fournir au noyau pour le dissocier en nucléons isolés et immobiles.
[ E _ { text { noyau } } + E _ { l } = E _ { text { proton } } + E _ { text { neutron } } ]
[ E _ { l } = E times m _ { p } times c ^ { 2 } + left( A - Z right) times m _ { n } times c ^ { 2 } - m _ { text { noyau } } times c ^ { 2 } ]
[ E _ { l } = c ^{ 2 } times left( left( Z times m _ { p } + left( A - Z right) times m _ { n } right) - m _ { text { noyau } } right) ]
[ E _ { l } = Delta m times c ^ { 2 } ]
Energie de liaison par nucléon
Un nucléon correspond à un terme générique faisant référence aux différents composants d'un noyau atomique. En effet, par nucléon on sous-entend le terme proton et neutron qui sont tous deux ce qu'on appelle des baryons. De plus, il peut être intéressant de se souvenir que le nombre de nucléons d'un atome est, de façon générale, noté A et appelé nombre de masse.
C'est l'énergie qu'il faut fournir au noyau pour le dissocier. Ces énergies de liaisons peuvent être calculées pour chaque noyau et on peut calculer pour chaque noyau son énergie de liaison par nucléon.
Atome et molécule
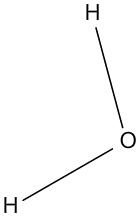
On l'a compris, la matière n'est finalement qu'un assemblage d'atomes mais la façon dont ils s'assemblent est très différente suivant le corps considéré. Dans un morceau de fer, on a un empilement d'atomes de fer identiques mais dans l'eau les atomes sont associés entre eux par "paquets" identiques d'atomes. Un "paquet" est appelé molécule, dans le cas de l'eau chaque "paquet" contient 1 atome d'oxygène et 2 atomes d'hydrogène.
Modèle moléculaire de l'eau

Pour visualiser une molécule, on va donc représenter les atomes sous formes de boules et les assembler comme dans un jeu de mécano mais pas n'importe comment ! On obtient un modèle moléculaire qui montre comment les atomes sont liés entre eux et disposés dans la molécule.
Une molécule est formée par un groupe d'atomes liés entre eux.
La molécule et sa formule
Une molécule peut être très complexe, le saccharose ou sucre par exemple (voir ci-contre) contient 45 atomes. Et ce n'est pas la pire ! Pour connaître la composition des différents atomes dans molécule et leur nombre, on utilise une formule.
La formule est formée par les symboles des atomes présents, le nombre de chaque atome présent est écrit en bas à droite du symbole (en indice). L'indice 1 ne s'écrit pas, on écrit juste le symbole de l'atome.
La formule de la molécule d'eau s'écrit : H2O
Déterminer la géométrie d'une molécule
Les représentations comme la formule brute, la formule développée ou la représentation de Lewis permettent de rendre compte de la composition d’une molécule, de l’enchaînement des atomes et de la présence des doublets non liants, mais elles ne fournissent pas d’informations sur la répartition spatiales des atomes dans une molécule.
En effet, dans la représentation de Lewis, on fait apparaître les doublets non liants.
Dans la représentation développée, ces doublets n'apparaissent plus. Enfin, dans la représentation semi-développée, les liaisons entre les hydrogènes et les carbones ne sont plus représentées. Pour bien visualiser la forme en trois dimensions d'une molécule, on utilise des règles simples.
La géométrie d’une molécule dépend de l’orientation des liaisons par rapport aux atomes . Les doublets liants et non liants sont donc responsables de la géométrie d’une molécule.
En effet, ces doublets sont constitués d’électrons chargés négativement qui ont tendance à se repousser, ainsi ils vont s'orienter pour s'éloigner au maximum.
A retenir : une molécule adopte la géométrie qui lui confère la plus grande stabilité en éloignant le plus possible, les uns des autres, les doublets liants et non liant.
La représentation de Cram
Avant d'étudier la géométrie des molécules, il faut utiliser des règles d'écriture bien précises. La représentation de Cram a été introduite par le chimiste Donald James Cram en 1953.
Pour indiquer la répartition spatiale des atomes dans une molécule on peut utiliser la représentation de Cram qui utilise les conventions suivantes :
- Le plan dans lequel on étudie la molécule est le même que le plan de la feuille sur laquelle on travaille,
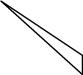
- On utilise un trait plein pour représenter un atome situé dans le plan,
- On utilise un triangle ou un trait plein épais pour représenter un atome se trouvant en avant du plan,
- On utilise un trait en pointillé ou un triangle hachuré pour représenter un atome sur trouvant en arrière du plan.
Ces représentations sont résumées dans le tableau suivant :
| Un trait plein correspond à une liaison dans le plan de représentation | Un triangle en contours pleins correspond à une liaison qui pointe vers l'avant du plan de représentation | Un triangle hachuré représente une liaison qui pointe vers l'arrière du plan de représentation |
 |  |  |
La représentation de Cram permet de représenter les molécules et leurs liaisons. L'avantage de cette représentation est qu'elle permet de mettre en perspective la molécule étudiée.
Pour aller plus loin : il existe d'autres types de représentations comme la représentation de Fisher ou la représentation de Haworth qui sont utilisées pour étudier les molécules cycliques comme les glucides, ou la représentation de Newman qui est une projection.
Géométrie de molécules simples
Si l'on applique le principe d'éloignement maximum alors on peut prévoir la géométrie d'une molécule simple constituée d'un atome central respectant la règle de l'octet.
Un tel atome comporte au total 8 électrons sur sa couche externe et il est donc entouré de 4 doublets (liants et non liants). L'éloignement maximal aboutit à une géométrie où les doublets forment un tétraèdre.
Géométrie des molécules : le méthane
Le méthane à pour formule CH4. Le carbone central est entouré de 4 doublets liant qui donnent effectivement à la molécule une forme tétraédrique.
| Répartition des doublets autour du carbone | Géométrie de la molécule de méthane |
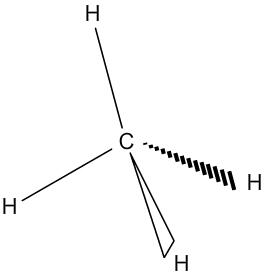 | 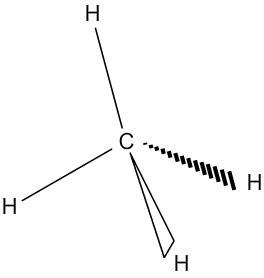 |
Géométrie des molécules : l'ammoniac

L'ammoniac a pour formule NH3. L'azote central est entouré de 3 doublets liants et d'un doublet non liant. Le tétraèdre formé par tous les doublets n'est donc pas complet puisque l'un d'entre eux n'est lié à aucun atome. L'azote et les hydrogènes auxquels il est lié s'inscrivent donc dans une forme pyramidale.
| Répartition des doublets autour de l'azote | Géométrie de la molécule d'ammoniac |
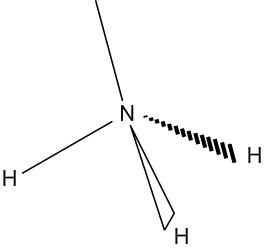 | 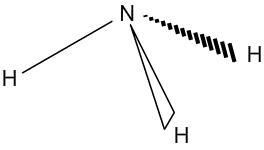 |
Géométrie des molécules : l'eau
L'eau a pour formule H2O. L'oxygène central est entouré de 2 doublets liants et de 2 doublets non liants.
Le tétraèdre formé par tous les doublets n'est donc pas complet puisque deux d'entre eux ne sont liés à aucun atome.
L'oxygène et les deux hydrogènes auxquels il est lié s'inscrivent donc dans une forme en "V", on aussi de forme coudée.
| Répartition des doublets autour de l'oxygène | Géométrie de la molécule d'eau |
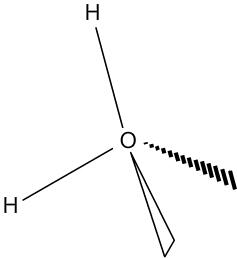 |  |
Géométrie des molécules : la méthode VSEPR
La méthode VSEPR (Valence Shell Electron Pair Repulsion) a été inventée par le chimiste R.J Gillespie en 1957. Cette méthode permet de visualiser la forme d’une molécule dans l’espace.
Cette méthode est aussi appelée théorie de Gillespie.
Il s’agit d’une méthode de représentation des molécules basée sur la théorie de la répulsion des électrons de la couche de valence : les paires d’électrons liantes et libres se repoussent mutuellement.
Cette représentation permet de visualiser la représentation de Lewis dans l’espace et permet de compléter la représentation de CRAM.
La méthode VSEPR permet également de pouvoir étudier la réactivité des molécules et prévoir l'existence de moments dipolaires électrostatiques (comme les forces de Van Der Waals).
Les molécules peuvent être ainsi décrites grâce à ce système :
AXmEn
- A : représente l’atome central
- X : représente les paires d’électrons liantes
- E : représente les paires d’électrons libres
Les nombres m et n représentent respectivement les nombres de doublets liants et de doublets non liants.
- Molécules possédant deux doublets : AX2E
Cas des molécules AX2E : les molécules AX2E possèdent deux paires d’électrons liants. Les deux paires sont opposées au maximum et la molécule est linéaire (180°).
Un exemple de ce type de molécules est le dioxyde de carbone (CO2).
- Molécules possédant trois doublets : AX3, AX2E, AXE2
Cas des molécules AX3 : dans ce cas, les doublets électroniques se repoussent pour former un triangle équilatéral parfait dont les angles sont égaux à 120°.
La molécule SO2 est un exemple de molécule dont la configuration dans l’espace forme un triangle équilatéral.
- Molécules possédant quatre doublets : AX4, AX3E, AX2E2, AXE3
Cas des molécules AX4 : les molécules possédant quatre doublets ont une géométrie en forme de tétraèdre. Les angles formés par les molécules sont de 109°.
Les molécules possédant ce type de géométrie sont par exemple le méthane (CH4).
- Molécules possédant cinq doublets : AX5, AX4E, AX3E2, AX2E3, AXE4
Cas des molécules AX5 :quand les molécules possèdent 5 doubles, les atomes se placent dans une configuration de bipyramide trigonale. Ce type de molécules possèdent des angles de 90° et des angles de 120°.
La molécule PCl5 répond à ce type d’agencement spatial.
- Molécules possédant six doublets : AX6 AX5E, AX4E2, AX3E3, AX2E4, AXE5
Cas des molécules AX6 : les molécules avec six doublets possèdent une géométrie de bipyramide à base carrée (octaèdre) avec des angles de 90°. La molécule SF6 est une molécule présentant une géométrie octaédrique.
Tableau récapitulatif :
| Description | Forme | Exemple de molécule |
|---|---|---|
| AX2 | Linéaire | CO2 |
| AX3 | triangulaire plane ou trigonale | BCl3 |
| AX4 | Tétraèdre | CH4 |
| AX5 | Bipyramide trigonale | PF5 |
| AX6 | Octaèdre | SF6 |
Note : l'existence des doublets non liants peut modifier les angles.
Labilité de la structure
Une fois que l'on est sûr que la molécule est la bonne, il peut être intéressant d'avoir recourt à une formule VSEPR, c'est à dire Valence Shell Electron Pair Repulsion, afin de décrire la structure de la molécule.
En effet, en prenant l'exemple d'une structure en bipyramide trigonales, on considère la molécule présente une structure labile. Cela signifie que, par une pseudo rotation de Berry, les deux atomes apicaux peuvent s'échanger avec deux atomes équatoriaux tandis que le troisième atome, qui reste donc inchangé, est appelé pivot de la pseudo rotation.
On peut alors, via la description VSEPR d'une molécule, décrire sa labilité.
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions qui concernent principalement la nature des liaisons entre atomes :
- Les atomes dans une molécule sont liés par des paires d'électrons ;
- Deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples ;
- Certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants ;
- Les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces ;
- Les doublets non liants occupent plus de place que les doublets liants ;
- Les liaisons multiples prennent plus de place que les liaisons simples.
Exemple de géométrie d’une molécule connue : le dioxyde de carbone
La molécule de gaz carbonique est composée d’un atome de carbone (Z=6) et de deux atomes d’oxygène (Z=8).
L’atome d’oxygène possède 8 électrons, dont 6 se répartissent sur la couche externe, l’atome d’oxygène possède deux doublets non liants et deux électrons célibataires.
L’atome de carbone (Z=6) possède 4 électrons célibataires et peut donc contracter 4 liaisons.
Afin de satisfaire à la règle de l’octet, le carbone est lié aux deux atomes d’oxygène par l’intermédiaire de deux doublets liaisons.
- L’atome central A est représenté par le carbone
- Le carbone engage deux liaisons doubles avec deux atomes d’oxygène, m = 2
- L’atome central de carbone ne possède pas de doublets non liants, n =0
- La géométrie de la molécule de gaz carbonique est de type AX2 et la molécule est linéaire.
Exemple du méthane
Le méthane (ou gaz naturel) est composé d'un atome central de carbone (Z=6) entouré de 4 atomes d'hydrogène (Z=1).
Le carbone possède 4 électrons célibataires qui lui permettent de former 4 liaisons avec 4 hydrogènes. Les hydrogènes, quant à eux, possèdent un électron célibataire, et peuvent former une liaison.
Selon la théorie de Gillespie, on a donc :
- Un atome central A représenté par le carbone
- Le carbone engage 4 liaisons avec 4 atomes d'hydrogène donc m = 4
- Le carbone ne possède pas de doubles non liants, n = 0
- La géométrie de la molécule de méthane est de type AX4 et la molécule est un tétraèdre avec des angles de 109°.
Exemple de l'ammoniac
L'ammoniac est une molécule formée d'un atome d'azote (Z = 7) et de trois atomes d'hydrogène (Z=1). L'azote possède 3 électrons célibataires et peut former 3 liaisons et possède également un doublet non liant. Les hydrogènes peuvent former une liaison chacun.
Ainsi :
- L'atome central A est l'atome d'azote
- L'azote engage 3 liaisons avec les 3 atomes d'hydrogène donc m = 3
- L'azote possède un doublet non liant, alors n=1
- La géométrie du méthane est de type AX3E, les atomes d'hydrogène forment une base pyramidale et l'atome d'azote se trouve au sommet de cette pyramide.
Exemple de l'eau
L'eau est formée d'un atome d'oxygène (Z=8) et de deux atomes d'hydrogène (Z=1). L'atome d'oxygène possède deux électrons célibataires et peut former 2 liaisons, il possède deux doublets non liants.
Les hydrogènes peuvent former une liaison chacun.
- L'atome A est l'atome d'oxygène
- L'oxygène engage 2 liaisons avec 2 atomes d'hydrogène donc m =2
- L'oxygène possède 2 doublets non liants donc n=2
- La géométrie de l'eau est de type AX2E2 et devrait être de type tétraédrique mais les angles sont plutôt de 104°, cela est expliqué par l'existence des doublets non liants génèrent des répulsions plus fortes.
Connaître la polarisation d'une molécule
Électronégativité des atomes
Dans le domaine de la chimie, on décrit l'électronégativité comme étant une grandeur physique caractérisant la capacité d'un atome à attirer un ou plusieurs électrons lors de la formation d'une liaison chimique avec une autre espèce.
Selon leur configuration électronique, certains atomes capteront les électrons facilement alors que d'autres n'y arriveront pas. Par exemple, l'atome de fluor a pour configuration k2l7, il gagnera facilement un électron pour saturer la couche l.
La facilité des atomes à capter un électron s'appelle l'électronégativité. Dans le tableau périodique, les atomes les plus électronégatifs se trouvent en haut à droite.
Polarité d'une liaison chimique
Lorsque deux atomes sont liés chimiquement, c'est qu'ils mettent en commun deux électrons. Les deux électrons sont alors en orbite autour des deux noyaux, ils forment alors la liaison.
Dans le cas de deux atomes identiques, le doublet est également partagé et symétrique par rapport à l'axe de liaison.
Dans le cas où, les deux atomes sont différents, celui qui est le plus électronégatif attire plus fortement le doublet. Le nuage électronique est alors plus dense du côté de l'atome le plus électronégatif et crée une charge négative à cet endroit et positive sur l'autre atome. Une telle molécule possède deux pôles électriques, on dit qu'elle est polarisée.
Les liaisons entre atomes au sein d'une molécule

Dans un solide moléculaire les atomes sont liés par des liaisons covalentes : les deux atomes mettent en commun leurs électrons célibataires pour créer un doublet liant.
Quand les deux atomes sont identiques, la paire d’électron qui relie les deux atomes est répartie équitablement entre les deux atomes. On dit alors que la molécule est apolaire.
Quand deux atomes qui mettent leurs électrons en jeu sont différents et qu’il existe une différence d’électronégativité significative entre ces deux atomes, la liaison est dire polarisée et on appelle ce type de molécule, molécule polaire.
Une liaison covalente est dite polarisée si les deux atomes qui sont liés ont des électronégativités très différentes. En effet, dans ce cas, un des deux atomes aura tendance à attirer les électrons, ce qui a pour effet de polariser la liaison. Plus la différence d’électronégativité est grande et plus la polarisation de la liaison sera importante. Il se forme ainsi une sorte de dipôle électrique.
Le décalage des électrons conduit à noter une charge partielle négative δ– sur l’atome le plus électronégatif et une charge partielle positive δ+ sur le moins électronégatif
La stabilité des structures électroniques est aussi impactée par l'électronégativité.
L’électronégativité d'un élément est sa capacité à attirer les électrons lors de la création de liaisons chimiques avec d'autres éléments
On peut trouver l'électronégativité d'un élément grâce à sa position dans le tableau périodique des éléments.
En effet il existe un lien entre la période et l'électronégativité.
Par exemple, en lisant le tableau de gauche à droite, sur une période, l'électronégativité augmente. Il en va de même si on lit le tableau de bas en haut par colonne.
La classification périodique des éléments, aussi appelée tableau de Mendeleïev, du nom de son créateur. C’est un chimiste russe qui en 1869 créa un tableau dont le but était de regrouper tous les éléments chimiques connus par points communs (groupes et familles par exemple). Il a souvent été ajusté et mis à jour depuis cette époque.
Sa dernière révision date de 2016 par l’UICPA (Union internationale de chimie pure et appliquée), une ONG suisse qui a pour but l’évolution de la physique-chimie. Le tableau périodique compte à ce jour 118 éléments.
Les forces de Van Der Waals au sein d'une molécule
Nommées ainsi en l'honneur de Johannes Diderik van der Waals, un physicien néerlandais du XIX -ème siècle, ces forces peuvent se décrire comme les interactions électroniques entres les atomes ou molécules, qui les lient ensemble.
Johannes Diderik van der Waals fut le premier à les prendre en compte dans ses calculs en 1873. Cela lui valut de recevoir en 1910 le prix Nobel de physique.
Un prix Nobel, Nobelpriset de son nom original en suédois, est une récompense au niveau mondial qui gratifie son détenteur d’être l’une des personnes ayant apporté le plus grand bénéfice à l’humanité. C’est un prix qui se remet tous les ans. Le premier a été remis en 1901. Ils récompensent des découvertes ou un travail en faveur de la paix.
Il en existe 5 : le prix Nobel de physique, le prix Nobel de chimie, le prix Nobel de la paix, le prix Nobel de médecine et de physiologie et le prix Nobel de littérature.
Ce phénomène s'explique par la répartition des charges au sein d'une molécule ou au sein des couples d'atomes. Pour plus de détails, il faut néanmoins se plonger dans la physique quantique pour en comprendre les principes les plus poussés.
On peut leur trouver trois origines :
- L'interaction électrostatique attractive entre deux multipôles induits, il s'agira dans ce cas des forces de London ;
- L'interaction attractive entre un multipôle permanent et un multipôle induit et il s'agira des forces de Debye ;
- L'interaction électrostatique attractive ou répulsive entre deux multipôles permanents selon leurs orientations, il s'agit alors des forces de Keesom.
Les exemples les plus flagrants des effets des forces de Van Der Waals sont les absorptions par capillarité ainsi que les systèmes d'accroche des pattes de gecko qui peuvent coller aux murs.
Il existe plusieurs types de forces qui font que les molécules s'attirent les unes les autres. Vous en avez quelques exemples dans notre partie ci-dessus.
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour , j’etais a la recherche d’une explication des angles du diedre de l’eau. Mais il semble que le mystere s’epaissit de plus en plus.
j’ai lu et vu des dessins ou l’on montre le diedre de l’eau entre les atome d’hydrogene a 104,5° mais apres on nous montre des des liaisons de molecules faisant des hexagones et parfois de pentagones mais ces interactions n’ont jamais fait un angle de 104,5°. S’agit il d’une fake new que l’on colporte partout sur internet? ou y a t-il une explication rationnelle qui permette de comprendre comment on peut former un hexagone avec des angles de 104,5°. Merci de votre reponse . Cordialement Dominique
Bonjour, nous serions ravis de vous aider ! Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique « Découvrir nos Superprofs » en indiquant le sujet de votre question. Vous trouverez de nombreux professeurs près de chez vous. Bonne journée ! 🙂
bonjour, c’est quoi déjà un CH3 dans les formules topologiques ?
Bonjour,
La liaison C-H est une liaison chimique entre un atome de carbone et un atome d’hydrogène, qu’on trouve principalement dans les composés organiques.
Bonne journée !
Merci beaucoup, j’avais du mal avec les doublets non liants, tout est clair maintenant!
Merci!!
Clair et bien détaillé!
REally Good les gars bien ouéj les potos, ca aide de ouf
bonsoir