Chapitres

La conduction dans les solutions électrolytiques
Nature du courant électrique
Contrairement aux métaux où la conduction est assurée par le déplacement des électrons libres, dans les solutions électrolytiques, le courant électrique est dû à la double migration des ions : les cations (ions positifs) se déplacent dans le sens conventionnel du courant, et les anions (ions négatifs) se déplacent en sens inverse.

Définition et mesure de la conductance (G)
La conductance (G) est la capacité d'une colonne de liquide à laisser passer le courant électrique. Elle se mesure en siemens (S) et est l'inverse de la résistance électrique R (mesurée en ohms $\Omega$) :
G = 1 / R
En appliquant la loi d'Ohm (U = R . I), la conductance se définit par le rapport entre l'intensité I et la tension U mesurées aux bornes de la cellule conductimétrique (composée des deux électrodes) :
G = I / U
La conductivité (σ) et les facteurs d'influence
Relation entre conductance (G) et conductivité (σ)
La conductance G est influencée par les paramètres géométriques de la cellule : la surface S des électrodes et la distance L qui les sépare. Pour s'affranchir de ces paramètres, on définit la conductivité (σ) de la solution, mesurée en siemens par mètre (S/m), qui est une grandeur intrinsèque à la solution :
G = σ . (S / L)
La conductivité σ est le facteur de proportionnalité (où k = S/L est la constante de cellule). Elle est caractéristique de la solution et ne dépend que de sa composition et de sa température.

Facteurs influençant la conductivité (σ)
- La concentration (c) : Aux faibles concentrations, σ est directement proportionnelle à c (courbe d'étalonnage linéaire).
- La nature des ions : La taille, la charge et le degré de solvatation (hydratation en solution aqueuse) des ions influencent fortement leur mobilité, et donc la valeur de σ.
- La température : L'agitation des molécules favorise la mobilité des ions et augmente donc la conduction.
Loi de Kohlrausch et conductivité molaire ionique
La conductivité molaire ionique (λ)
La conductivité σ d'une solution ionique est la somme des contributions de tous les ions présents. Chaque contribution est définie par la conductivité molaire ionique (λi) de l'ion :

Où [Xi] est la concentration molaire effective de l'ion Xi. L'unité de λi est le siemens mètre carré par mole. Les valeurs de λi sont répertoriées dans des tables et sont particulièrement élevées pour les ions H3O+ et HO-.
Application à la concentration
Pour une solution diluée d'un soluté simple comme 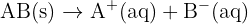 de concentration c, la loi de Kohlrausch simplifiée montre une proportionnalité directe :
de concentration c, la loi de Kohlrausch simplifiée montre une proportionnalité directe :
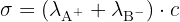
Si le soluté est du type 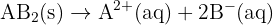 , la conductivité est alors
, la conductivité est alors 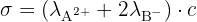 , car la concentration en B- est le double de celle de A2+.
, car la concentration en B- est le double de celle de A2+.
Tableau de Synthèse des Grandeurs Conductimétriques
Ce tableau résume les grandeurs physiques fondamentales, leurs formules, et leurs unités, en lien avec la loi d'Ohm.
| Grandeur | Symbole | Formule de Définition | Unité (SI) | Dépend de... |
|---|---|---|---|---|
| Résistance | R | R=U*I (Loi d'Ohm) | Ohm (Ω) | Conductivité, Géométrie (L/S). |
| Conductance | G | G=1/R | Siemens (S) | Conductivité (σ), Géométrie (S/L). |
| Conductivité | σ | σ=G(L/S) | Siemens par mètre (S/m) | Nature des ions, Concentration, Température. |
| Conductivité Molaire Ionique | λi | λi = σi/[Xi] | S.m²/mol | Nature et mobilité de l'ion. |

Méthodes de dosage par conductimétrie
1. Dosage par étalonnage (Courbe d'étalonnage)
Cette méthode consiste à mesurer la conductivité σ de plusieurs solutions étalons de concentrations connues c, puis à tracer la courbe d'étalonnage (Σ = f(c)). Aux faibles concentrations, cette courbe est une droite passant par l'origine (proportionnalité). La concentration d'une solution inconnue (comme le sérum physiologique) est ensuite déterminée par lecture graphique sur cette droite.
2. Titrage conductimétrique (Exemple du lait)
Le titrage conductimétrique (utilisé par exemple pour doser les ions chlorure Cl- dans le lait) suit l'évolution de la conductivité σ lors de l'ajout progressif d'un réactif titrant Ag+ + NO3-) :
Cl⁻ (aq) + Ag⁺ (aq) → AgCl (s)
Avant l'équivalence : Les ions Cl- sont consommés et remplacés par les ions NO3-. Comme [NO3-] est souvent inférieure à [Cl-], la conductivité σ diminue légèrement.
Après l'équivalence : Tous les ions Cl- ont réagi. Les ions Ag+ et NO3- ajoutés s'accumulent dans la solution, provoquant une augmentation forte et linéaire de σ.
Le volume équivalent (VE) est déterminé graphiquement au point d'intersection des deux droites. Ce point permet de calculer la quantité initiale d'ions titrés dans l'échantillon (quantité versée stœchiométriquement égale à la quantité initiale).
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !