Chapitres

Caractère polaire des molécules et formation des ions
Électronégativité et polarité des liaisons
L'électronégativité d'un élément est la tendance d'un atome de cet élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé. En général, l'électronégativité des éléments augmente lorsqu'on se déplace :
De gauche à droite dans une période (ligne) du tableau périodique.
De bas en haut dans une famille (colonne) du tableau périodique.
Lorsqu'une liaison chimique unit deux atomes différents, l'atome le plus électronégatif attire plus fortement le doublet d'électrons de liaison. Le nuage électronique est alors plus dense de son côté, créant une densité électrique négative (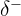 ) sur cet atome et une densité électrique positive (
) sur cet atome et une densité électrique positive (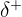 ) sur l'autre. Une telle liaison est dite polarisée.
) sur l'autre. Une telle liaison est dite polarisée.
Si une molécule présente deux pôles électriques distincts (barycentres des charges positives et négatives distincts), on dit qu'elle est polaire ou dipolaire. La molécule de chlorure d'hydrogène et la molécule d'eau en sont des exemples notables.
Les solides ioniques : structure et cohésion
Les solides ioniques sont constitués d'anions (ions négatifs) et de cations (ions positifs) régulièrement disposés dans l'espace pour former une structure solide appelée cristal. Un solide ionique est toujours électriquement neutre : il contient autant de charges positives que de charges négatives. Sa formule statistique traduit cette neutralité.

La cohésion (solidité) du cristal est assurée par l'interaction coulombienne, c'est-à-dire la force d'attraction électrique entre les ions de signes opposés. À cette échelle, c'est la force électrique qui domine largement par rapport à la force de gravitation (le poids). La température de fusion élevée des solides ioniques (par exemple, 801 °C pour le sel) témoigne de la force de ces liaisons.
Dissolution et obtention des solutions électrolytiques
La solution électrolytique et l'électrolyte
Une solution électrolytique est obtenue en dissolvant un soluté (solide, liquide ou gaz) dans un solvant. Si le solvant est l'eau, on parle de solution aqueuse. Une solution électrolytique est une solution qui :
- Contient des ions.
- Conduit le courant électrique.
- Est électriquement neutre dans son ensemble.
L'électrolyte est le milieu conducteur (solution ionique) dans lequel baignent les anions et les cations, et qui permet le passage du courant.
Le processus de dissolution en trois étapes
La dissolution des solutés ioniques (ou électrolytes) dans l'eau se déroule en trois phases, grâce au caractère polaire de la molécule d'eau :
La dissociation : les ions du cristal sont attirés par les molécules d'eau polaires, ce qui désagrège le cristal et disperse les ions dans le volume de liquide.
La solvatation (ou hydratation si le solvant est l'eau) : par attraction électrostatique, chaque ion passé en solution s'entoure d'un « bouclier » de molécules d'eau. Ce phénomène est noté par l'indice 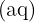 (ex :
(ex : 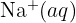 ).
).
La dispersion : les ions solvatés circulent librement et finissent par occuper tout le volume de la solution.
| Étape de la Dissolution | Description du Phénomène | Conséquence sur le Système |
|---|---|---|
| Dissociation | Les molécules d'eau polaires attirent et séparent les ions du cristal. | Le cristal se désagrège ; les ions sont dispersés. |
| Solvatation (Hydratation) | Les molécules d'eau entourent les ions : le pôle négatif de  attire les cations ( attire les cations ( ), le pôle positif attire les anions ( ), le pôle positif attire les anions ( ). ). | Les ions sont isolés et stabilisés par un "bouclier" de molécules de solvant. |
| Dispersion | Les ions solvatés circulent librement et se répartissent uniformément dans le volume de la solution. | Formation d'une solution électrolytique homogène et conductrice. |
Le processus de dissolution d'un solide ionique (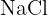 ) s'écrit :
) s'écrit :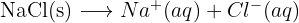
Le proton 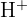 provenant de la dissolution de certains gaz ou liquides (comme
provenant de la dissolution de certains gaz ou liquides (comme 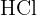 ou
ou  ) s'associe immédiatement à une molécule d'eau pour former l'ion oxonium
) s'associe immédiatement à une molécule d'eau pour former l'ion oxonium 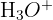 .
.
L'électrolyse : un processus forcé par le courant
Définition de l'électrolyse
L'électrolyse est une opération chimique forcée qui consiste à décomposer différentes matières (ions ou molécules) par un apport d'énergie électrique. Elle met en jeu deux couples rédox et les fait réagir dans le sens contraire de leur réaction naturelle (spontanée), grâce à l'énergie fournie par un générateur.
Un électrolyseur est le dispositif utilisé, composé d'une solution ionique (l'électrolyte) dans laquelle plongent deux électrodes reliées à un générateur.
Rôles des électrodes et migration des ions
Contrairement aux piles, les électrodes d'un électrolyseur sont polarisées par le générateur externe :
- L'anode est reliée au pôle positif (
 ) du générateur. Le courant y entre, et les électrons en sortent. Une oxydation (perte d'électrons) du réducteur s'y produit. Les anions (ions négatifs) y migrent.
) du générateur. Le courant y entre, et les électrons en sortent. Une oxydation (perte d'électrons) du réducteur s'y produit. Les anions (ions négatifs) y migrent. - La cathode est reliée au pôle négatif (
 ) du générateur. Le courant en sort, et les électrons y entrent. Une réduction (gain d'électrons) s'y produit. Les cations (ions positifs) y migrent.
) du générateur. Le courant en sort, et les électrons y entrent. Une réduction (gain d'électrons) s'y produit. Les cations (ions positifs) y migrent.
| Caractéristique | Anode | Cathode |
|---|---|---|
| Pôle du Générateur (Signe) | Positif | Négatif |
| Mouvement des Électrons | Les électrons sortent de l'électrode | Les électrons entrent dans l'électrode |
| Réaction Chimique | Oxydation (perte d'électrons) | Réduction (gain d'électrons) |
| Migration des Ions | Attire les anions (ions négatifs) | Attire les cations (ions positifs) |
Applications de l'électrolyse : le placage
L'électrolyse est fréquemment utilisée pour le placage (dorure, argenture, chromage, etc.). Ce procédé permet de recouvrir un objet d'une fine couche de métal.

Dans une opération de placage :
- L'objet à recouvrir est connecté à la cathode (pôle
 ).
). - Le métal à déposer (par exemple, le cuivre) est connecté à l'anode (pôle
 ).
).
En envoyant du courant, le métal de l'anode est oxydé et passe en solution sous forme d'ions, lesquels sont attirés par la cathode où ils se réduisent pour former la couche de placage sur l'objet.
Les transports de charges et d'énergie
Conductivité électrique et thermique
La conductivité électrique d'un matériau est sa capacité à laisser se déplacer les charges électriques (les électrons ou les ions) en son sein.
La conductivité thermique est l'aptitude d'un corps à conduire la chaleur par conduction, c'est-à-dire un transfert de chaleur direct de proche en proche par les vibrations des atomes et la communication de l'agitation des électrons. Cette caractéristique va souvent de pair avec la conductivité électrique, ce qui explique que les métaux (cuivre, aluminium) sont de bons conducteurs de chaleur.

Réactions exothermiques et endothermiques
La dissolution des électrolytes peut s'accompagner d'un changement de température :
Une réaction est dite exothermique si elle s'accompagne d'une libération de chaleur (hausse de température).
Une réaction est dite endothermique si elle récupère la chaleur du milieu extérieur (baisse de température).
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !