Chapitres

Découvrir le cuivre ??

L'élément cuivre (Cu) occupe une place remarquable dans le tableau périodique en tant que métal de transition du groupe 11.
??? Le Cuivre comprend le symbole chimique "Cu" provenant du mot latin "cuprum"
Le cuivre est un élément essentiel aux multiples facettes, offrant une gamme de propriétés et d'applications qui en font l'un des métaux les plus prisés dans l'histoire de l'humanité jusqu'à nos jours.
? Quelques propriétés du cuivre :
- Le cuivre est un métal de couleur rougeâtre, remarquable pour sa haute conductivité électrique et thermique
- Doté d'une excellente malléabilité et ductilité, il peut être aisément façonné en fils ou en feuilles pour diverses applications
- Sur le plan chimique, le cuivre présente une remarquable résistance à la corrosion, ce qui en fait un matériau idéal pour des utilisations industrielles et électroniques
Les composés courants du cuivre ⚛️

Oxydes de cuivre
? Les oxydes de cuivre, tels que le Cuivre(I) oxyde (Cu2O) et le Cuivre(II) oxyde (CuO), sont des composés courants du cuivre qui jouent un rôle important dans divers domaines de la science et de l'industrie.
- Le Cuivre(I) oxyde (Cu2O) est un composé de couleur rouge-brun, souvent trouvé sous forme de cristaux ou de poudre fine. Il est utilisé dans des applications variées, notamment en électrochimie pour la fabrication d'électrodes et de cellules solaires, ainsi que dans l'industrie du verre pour la coloration du verre rouge et pour la production de céramiques.
- Le Cuivre(II) oxyde (CuO) est quant à lui de couleur noire et se présente sous forme de poudre. Ce composé est largement utilisé comme catalyseur dans de nombreuses réactions chimiques, en tant que pigment pour les peintures et les colorants, et dans les batteries pour ses propriétés de stockage d'énergie.
? Ces oxydes de cuivre sont également étudiés pour leurs propriétés semiconductrices, ce qui les rend intéressants pour le développement de dispositifs électroniques et de technologies de pointe.
Sels de cuivre
? Les sels de cuivre, tels que le Sulfate de cuivre (CuSO4) et le Chlorure de cuivre (CuCl2), sont des composés courants du cuivre qui possèdent des applications variées dans différents domaines.
- Le Sulfate de cuivre (CuSO4) est un cristal bleu qui se dissout facilement dans l'eau. Il est utilisé dans l'agriculture comme fongicide pour prévenir et traiter les maladies des plantes. Il joue également un rôle important dans les piscines, où il est utilisé pour contrôler les algues et les bactéries. En chimie, le Sulfate de cuivre est utilisé comme réactif pour différentes réactions chimiques, et il est également utilisé dans la fabrication de pigments pour la peinture et la teinture.
- Le Chlorure de cuivre (CuCl2) est un sel vert qui se présente souvent sous forme de cristaux ou de poudre. Il est utilisé comme catalyseur dans certaines réactions chimiques, notamment dans les réactions d'oxydation. Il est également utilisé dans l'industrie textile pour teindre les tissus et dans la métallurgie pour raffiner le cuivre.
⚠️ Ces sels de cuivre jouent un rôle essentiel dans de nombreux secteurs industriels et agricoles, illustrant ainsi la diversité des applications du cuivre et de ses composés dans notre vie quotidienne. Cependant, en raison de leur toxicité, il est important de manipuler ces sels de cuivre avec précaution et de respecter les normes de sécurité lors de leur utilisation.
Alliages de cuivre
? Les alliages de cuivre, tels que le laiton (Cuivre-Zinc) et le bronze (Cuivre-Étain), sont des composés courants du cuivre qui possèdent des propriétés uniques et des applications diverses.
- Le laiton est un alliage constitué principalement de cuivre et de zinc, avec des proportions variables de chaque élément en fonction de l'application souhaitée. Ce matériau se caractérise par sa résistance à la corrosion, sa malléabilité et sa conductivité électrique. En raison de ses propriétés, le laiton est couramment utilisé dans la fabrication de pièces mécaniques, de composants électriques, d'instruments de musique, de bijoux et de divers accessoires.
- Le bronze est un alliage de cuivre avec l'addition d'étain et parfois d'autres métaux. Il est célèbre pour sa dureté, sa résistance à l'usure et sa capacité à produire des détails fins lors du moulage. Le bronze est utilisé dans la sculpture, la fabrication de cloches, de pièces d'horlogerie, de roulements et d'instruments de musique.
? Ces alliages de cuivre sont essentiels dans de nombreux domaines industriels et artistiques, grâce à leurs propriétés uniques et à leur polyvalence.
Les transformations de l'élément Cuivre
Il possible de passer d'une forme de l'élément cuivre à une autre par une transformation chimique.
Voici quelques exemples de réactions chimiques permettant d'obtenir certaines des espèces chimiques citées dans le paragraphe précédent :
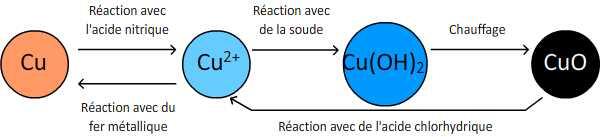
Première transformation
En versant de l'acide nitrique concentré sur du Cuivre métallique, une transformation chimique a lieu. L'acide nitrique concentré dissout le Cuivre métallique, entraînant un dégagement de fumées et de chaleur. Une solution d'ions Cuivre II (Cu 2+) bleue s'est alors formée.
? En faisant réagir une solution d'ions Cuivre II (Cu 2+) avec de l'hydroxyde de sodium (plus communément appelée la soude), une nouvelle transformation chimique a lieu et un précipité bleu d'Hydroxyde de Cuivre (Cu(OH)2) se forme.
? À noter qu'il s'agit d'ailleurs d'une méthode couramment utilisée pour mettre en évidence la présence d'ions Cuivre II (Cu 2+) dans une solution
Deuxième transformation
Enfin, en chauffant le précipité d'Hydroxyde de Cuivre (Cu(OH)2), un solide noir se forme petit à petit : de l'Oxyde de Cuivre (CuO). Au cours de cette transformation chimique, l'eau est progressivement éliminée de l'Hydroxyde de Cuivre.
? Cette transformation chimique est la réaction de déshydratation de l'Hydroxyde de Cuivre. Dans le sens inverse, en faisant réagir l'Oxyde de Cuivre avec de l'acide chlorhydrique, la transformation chimique qui a lieu mène à la formation d'ions Cuivre II (Cu 2+) en solution.
Troisième transformation
? Pour finir, la dernière transformation chimique consiste à plonger du Fer métallique dans une solution contenant des ions Cuivre II (Cu 2+), du Sulfate de Cuivre par exemple. Au début de l'expérience, en raison de la présence d'ions Cuivre II (Cu 2+), la solution est de couleur bleue. Puis la solution se décolore peu à peu et on voit apparaître sur le Fer métallique un dépôt de couleur rouge, correspondant à du Cuivre métallique.
? Ainsi, petit à petit, les ions Cuivre II (Cu 2+) ont disparu de la solution (ce qui explique la décoloration progressive) pour se transformer en Cuivre métallique (d'où l'apparition du dépôt rouge sur le Fer métallique)
Propriétés et utilisations des composés de cuivre ??

Les utilisations industrielles et commerciales du cuivre sont vastes et variées, mettant en évidence les propriétés uniques de cet élément.
? Dans l'agriculture, le Sulfate de cuivre est utilisé comme fongicide pour protéger les cultures des maladies fongiques :
- Il agit efficacement en tuant les agents pathogènes tout en étant respectueux de l'environnement
- De plus, il est utilisé pour maintenir la qualité de l'eau dans les piscines en éliminant les algues et les bactéries nuisibles.
? Dans l'industrie de la céramique et du verre, l'Oxyde de cuivre est un ingrédient essentiel dans la fabrication de pigments qui confèrent des couleurs uniques aux produits finis :
- De plus, il renforce les propriétés du verre, augmentant ainsi sa résistance et sa durabilité
- Dans les arts, l'oxyde de cuivre est utilisé pour créer des glaçures vertes et bleues saisissantes
? En électronique, les alliages de cuivre sont privilégiés pour leur haute conductivité électrique. Ces alliages sont utilisés dans les câbles, les connecteurs et les bobines des moteurs électriques. Dans l'électromagnétisme, le cuivre est utilisé dans les aimants et les transformateurs pour optimiser la transmission et la conversion de l'énergie électrique.
En somme, les utilisations industrielles et commerciales du cuivre démontrent la polyvalence de cet élément, qui continue de jouer un rôle essentiel dans différents secteurs économiques et dans notre vie quotidienne. Sa capacité à répondre à une grande variété d'exigences témoigne de son importance continue dans le développement technologique et médical de la société moderne.
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Je demande à savoir sur tous les métaux Cite cuivre cobalt et nickel et zinc et fer et plomb et cadmium ET manganese et sodium
Bonjour ! Je vous encourage à explorer l’offre de nos professeurs passionnés sur Superprof. Ils sont prêts à vous fournir un accompagnement sur mesure pour vous aider à réaliser vos objectifs, adapté à vos besoins. Passez une excellente journée !
Je veux juste un bon enseignement avec des professeurs
Bonjour, j’ai créé un revêtement sous brevet avec une bases importante de micro particules de CU , ce revêtement a pour fonction de ne plus avoir de salissures sur les œuvres vives de bateaux. Je voudrais ne plus avoir cette couleur cuivrée ! Je voudrais avoir, soit du noir où du blanc ou bleu ! Que faudrait-il que je puisse faire ? Si j’emploie de l’oxyde de cuivre ? Je vais avoir les mêmes bénéfices ?
Je vous remercie pour vôtre aide.
Amicalement.
Jaime ca merci a vous
merci bcp. très intéressant
bonjour,
Pouvez vous m’aider à calculer le nombre d’ion cuivre(Cu²+²) dans 2,5 moles d’ions cuivre.
Adam
Bonjour pourriez vous m’aider à établir un mode opératoire pour la réduction du cuivre métallique par l’acide sulfurique en présence du peroxyde d’hydrogène comme oxydant
Bonjour ! Voici deux cours complémentaires où vous pourrez obtenir des pistes de réflexion :
https://www.superprof.fr/ressources/scolaire/physique-chimie/tout-niveau/dictionnaire/presentation-et-proprietes-du-cuivre.html
https://www.superprof.fr/ressources/scolaire/physique-chimie/seconde/structure-matiere/ion.html
En espérant que vous y trouviez votre bonheur, bonne journée !