Chapitres

Carte d'identité du Meitnerium
Le Meitnerium est un élément chimique métallique et solide, de symbole atomique Mt et de numéro atomique Z = 109. Sa structure électronique est donc la suivante : (K)2(L)8(M)18(N)32(O)32(P)15(Q)2 soit 109 électrons répartis dans les différentes couches. Dans le tableau périodique, il est situé sur la septième période et dans la neuvième colonne: il a des propriétés qui semblent se rapprocher de celles des espèces appartenant à la famille des métaux de transition. 
| Symbole atomique: Mt Numéro atomique: Z= 109 Principal isotope: / Structure électronique:(K)2(L)8(M)18(N)32(O)32(P)15(Q)2 Configuration électronique: 1s22s22p63s23p63d104s24p64d104f145s25p65d105f146s26p66d77s2 Période: 7 Groupe: 9 Famille: métaux de transition (supposé) Electronégativité: / Masse molaire atomique: 268,1 g/mol | Symbole 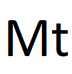 Localisation dans la classification Localisation dans la classification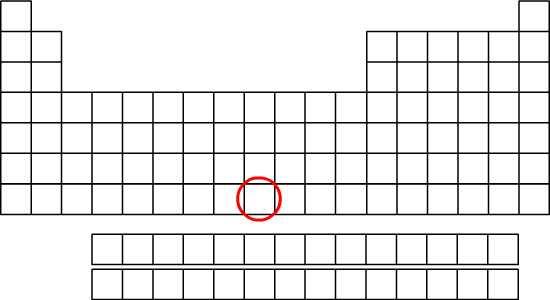 |
Histoire du Meitnerium
Origine du mot Meitnerium
L'élément 109 a été nommé Meitnerium en hommage à Lise Meitner, physicienne autrichienne naturalisée suédoise, ayant notamment contribué à la découverte du phénomène de fission nucléaire et co-découvreuse de l'élément protactinium. L'appellation n'a été définitive que très tardivement. En effet, pendant longtemps, des équipes de chercheurs se sont disputées la découverte d'éléments de numéro atomique entre 102 et 109 : cette période a d'ailleurs été nommée la "guerre des transfermiens". Elle a d'ailleurs débuté dans les années 60, soit bien avant la découverte du Meitnerium. Ainsi, jusqu'alors le Meitnérium était appelé "unninelium" en accord avec la nomenclature de l'UICPA. La suggestion de l'appellation "Meitnerium" a été faite en 1992 par l'équipe du GSI. Il a par la suite était recommandé en 1994 par l'UICPA, puis a été définitivement appelé "Meitnerium" en 1997 toujours sur décision de l'UICPA.
La découverte du Meitnerium, un peu d'histoire
L'élément 109 est synthétisé pour la première fois en août 1982 au centre de recherche sur les ions lourds (GSI) à Darmstadt en Allemagne. 
Les principaux isotopes du Meitnérium
Huit isotopes du Meitnerium ont été identifiés à ce jour.
Isotopes du Meitnerium présents dans la nature
Le Meitnerium étant un élément chimique issu d'une synthèse, il ne possède pas d'isotope stable, présent dans la nature
Isotopes radioactifs du Meitnerium
Tous les isotopes du Meitnerium sont donc des isotopes radioactifs : ce sont des radioisotopes. Ils ont des nombres de masse compris entre A = 266 et A = 278. Comme indiqué plus haut, le premier à avoir été synthétisé est l'isotope 266 du Meitnerium. Celui qui a le temps de demi vie le plus élevé est l'isotope de nombre de masse A = 278, avec une demi vie estimée à huit secondes. Les sept autres radioisotopes du Meitnerium ont des temps de demi vie inférieurs à la seconde. Un neuvième isotope du Meitnerium, avec un nombre de masse A = 282 existerait, mais il n'a pas encore été officiellement confirmé.
Propriétés chimiques et composés du Meitnerium
Jusqu'à présent, aucune étude expérimentale des propriétés chimiques du Meitnerium n'a encore été menée. Les faibles temps de demi vie de l'ensemble des isotopes rendent compliquées les investigations à propos des propriétés physiques et chimiques de cet élément. Cependant, selon les éléments issus de la théorie, il appartiendrait à la famille des métaux de transition et aurait notamment des propriétés analogues aux autres éléments chimiques du groupe 9 : le Cobalt, le Rhodium et l'Iridium. 






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !