Chapitres
L'objectif du cours va être de voir en détail quelles sont les différentes méthodes existantes pour représenter les molécules dans le plan, et comment utiliser chaque méthode.

La formule brute
La formule brute est la représentation la plus simple d'une molécule, connue depuis le collège. Elle est dite "brute" car elle ne fournit que le minimum d'informations sur la molécule représentée :
- La nature chimique des atomes qui composent la molécule. Leur symbole atomique est alors utilisé (par exemple : O pour Oxygène, C pour Carbone, H pour Hydrogène etc.)
- Le nombre de chaque atome, qui est précisé en indice de chaque symbole atomique.
Remarque : lorsqu'il n'y a pas de nombre en indice d'un atome, cela sous-entend qu'un seul atome est présent. Ci-dessous quelques exemples de formules brutes :
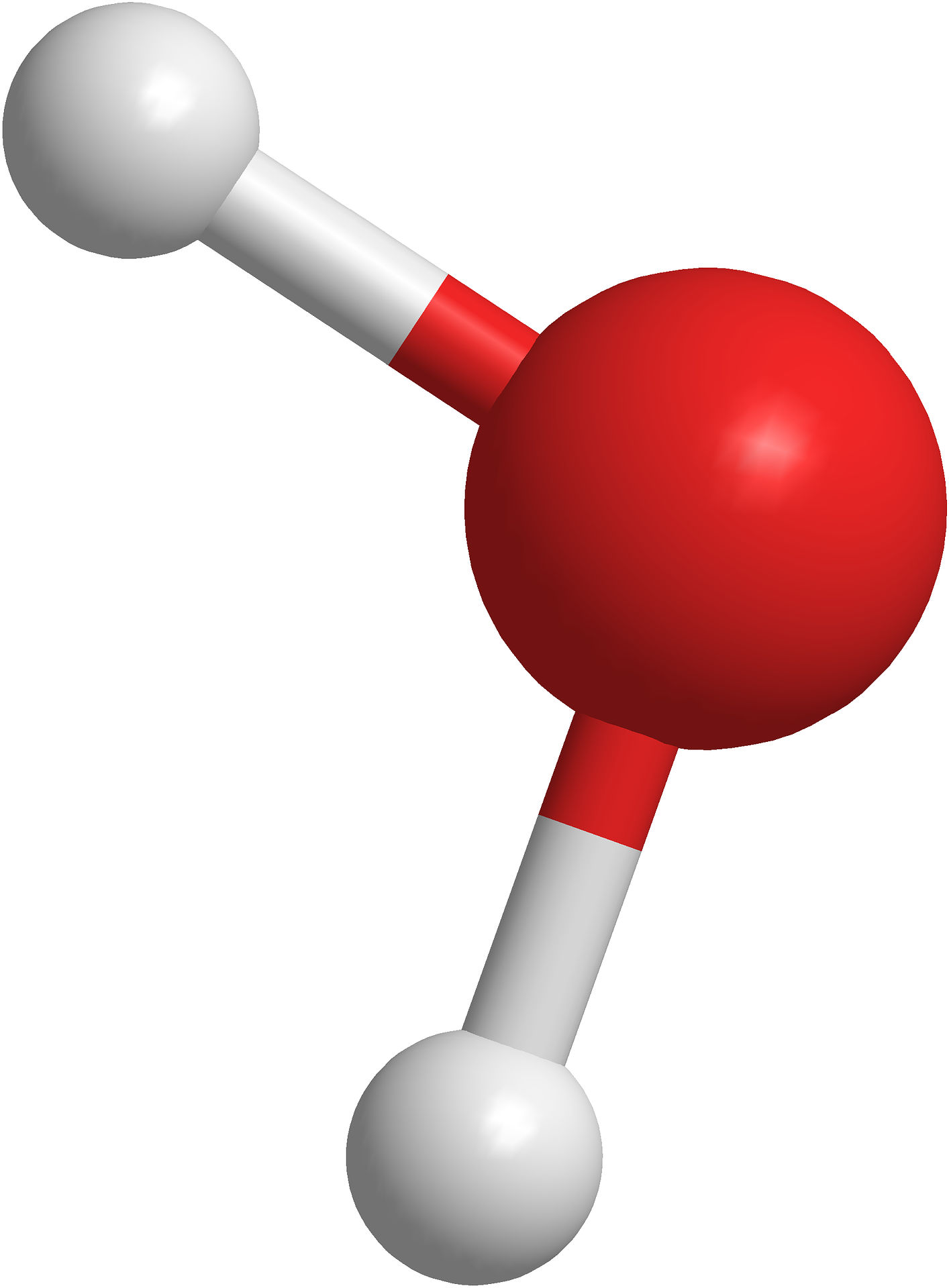
- Eau : H2O, soit deux atomes d'Hydrogène et un atome d'Oxygène
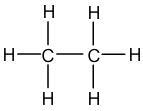
- Ethane : C2H6 , soit deux atomes de Carbone et six atomes d'Hydrogène
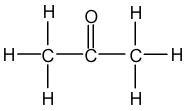
- Acétone : C3H6O , soit trois atomes de Carbone, six atomes d'Hydrogène et un atome d'Oxygène
La formule développée
A partir de la formule brute de la molécule, il est possible d'aller plus loin dans le développement et d'écrire la formule développée de cette molécule. Celle-ci va alors donner des indications sur la répartition des atomes dans la molécule ainsi que sur les liaisons covalentes qui existent entre les différents atomes.
Symboliser les liaisons
Les liaisons simples sont des liaisons covalentes symbolisées par un tiret entre deux atomes. Il est également possible d'écrire des liaisons multiples entre des atomes. En particulier, les doubles liaisons (ou liaisons doubles) qui représentent l'établissement de deux liaisons entre deux atomes, sont symbolisées par deux tirets parallèles. Enfin, il existe également les triples liaisons (ou liaisons triples), qui sont elles, symbolisées par trois tirets parallèles, correspondant à l'établissement de trois liaisons entre deux atomes.
Liaisons établies par les principaux atomes
Afin d'écrire facilement les formules développées, il est important de connaître le nombre de liaisons covalentes que peuvent établir les principaux éléments chimiques de la classification périodique. En effet, chaque atome ne va pouvoir former qu'un nombre limité de liaisons covalentes, ce nombre étant défini grâce aux règles du duet et de l'octet. Le tableau ci-dessous récapitule le nombre de liaisons covalentes que peuvent former les principaux éléments chimiques, ainsi que la forme que peuvent prendre ces liaisons (simples, doubles ou triples) :
| Atome | Symbole chimique | Nombre liaisons covalentes | Liaisons covalentes possibles |
|---|---|---|---|
| Hydrogène | H | 1 | 1 liaison simple |
| Oxygène | O | 2 | 2 liaisons simples ou 1 liaison double |
| Azote | N | 3 | 3 liaisons simples ou 1 liaison simple et 1 liaison double ou 1 liaison triple |
| Carbone | C | 4 | 4 liaisons simples ou 2 liaisons simples et une liaison double ou 2 liaisons doubles ou 1 liaison simple et 1 liaison triple |
Règles pour l'écriture des formules développées
Pour écrire la formule développée d'une molécule, il faudra appliquer les règles suivantes :
- Représenter chaque atome par son symbole chimique, autant de fois qu'il apparaît dans la molécule
- Représenter les liaisons covalentes par des tirets
- Associer à chaque atome le bon nombre de liaisons covalentes
Quelques exemples de formules développées
Exemple de l'eau : H2O
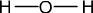
Exemple de l'éthane : C2H6

Exemple de l'Acétone : C3H6O

La formule de Lewis
La formule de Lewis est l'écriture d'une molécule sur laquelle on va faire apparaître l'ensemble des doublets d'électrons : les doublets qui forment les liaisons covalentes simples et multiples (= doublets liants) mais aussi les doublets qui ne participent pas aux liaisons covalentes (= doublets non liants). Par rapport à la formule développée, la formule de Lewis fait intervenir l'écriture des doublets non liants. Ainsi, pour écrire la formule de Lewis, il faut suivre les mêmes règles que pour l'écriture de la formule développée et y ajouter les doublets non liants. Reprenons les exemples précédents de l'eau, de l'éthane et de l'acétone :
| Eau | Ethane | Acétone |
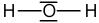 | 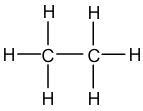 | 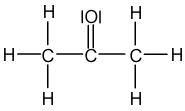 |
Inversement, en partant de la formule de Lewis, il sera possible de revenir à la formule développée en supprimant tous les doublets non liants de la représentation. La formule de Lewis est la représentation la plus riche, qui fournit le plus d'information sur la molécule représentée. Remarque : si les atomes d'une molécule ne comportent pas de doublets non liants alors la formule de Lewis et la formule développée sont identiques.
La formule semi-développée
Pour finir, la dernière représentation plane possible est la formule semi-développée. Cette forme de représentation d'une molécule est un intermédiaire entre la formule brute et la formule développée. Un peu plus compacte que la formule développée mais un peu plus détaillée que la formule brute, elle consiste à partir de la formule développée, et à masquer toutes les liaisons que les atomes d'Hydrogène font avec d'autres atomes. Quant aux autres liaisons, elles restent représentées. Ci-dessous se trouvent les exemples des formules semi-développées des molécules d'Eau, d'Ethane et d'Acétone.
- Sur la molécule d'eau, les liaisons entre l'Hydrogène et l'Oxygène ont été masquées
- Sur la molécule d'Ethane, la liaison covalente entre les deux atomes de Carbone reste apparente tandis que toutes les liaisons entre les atomes de Carbone et les atomes d'Hydrogène sont masquées
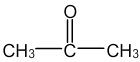
- Enfin, sur la molécule d'Acétone, les liaisons entre les atomes de Carbone ainsi que la double liaison entre l'atome de Carbone et l'atome d'Oxygène sont conservées, alors que les liaisons entre les atomes de Carbone et les atomes d'Hydrogène ont été masquées conformément à la règle d'écriture de la formule semi-développée.
| Eau | Ethane | Acétone |
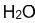 |  |  |





















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour
Monsieur vous pouvez me dire comment on passe de la représentation 3D a la rep 2D des molécule et merci d’avance?
J’ai rien compris mais j’ai trouvé ce qu’il me fallait donc Merci mon ami. Continuez de faire votre passion un jour peut être et je l’espère tu gagnera le prix Nobel.
bonjour, pouvez vous m’expliquer ce qu’est la formule topologique s’il vous plait, merci !
Bonjour,
Pourquoi dans la formule de la formule de la trinitrate de glycérine ou nitroglycerine C3H5N3O9 les atome de carbone et d’Hydrogène ne sont pas représentés ?