Chapitres
- 01. Les premiers modèles atomiques : La philosophie avant la preuve
- 02. La révolution scientifique des modèles atomiques
- 03. Le modèle quantique de l’atome
- 04. Les applications du modèle quantique aujourd’hui
- 05. Exercices : Testez vos connaissances sur l'atome !
- 06. Flashcards de révision sur l'atome
- 07. Sources
Regardez autour de vous. La chaise sur laquelle vous êtes assis, l'écran que vous regardez, l'air que vous respirez... De quoi tout cela est-il réellement fait ? Si l'on pouvait zoomer des milliards de fois sur la matière, que verrait-on ?
Cette question vertigineuse a animé les plus grands esprits de l'Histoire. Depuis l’Antiquité grecque, la représentation de la matière a subi de profondes mutations. Nous sommes passés d’une vision philosophique simple et indivisible, celle de Démocrite, à une description mathématique complexe et probabiliste fondée sur la mécanique quantique.
Comprendre l'évolution du modèle de l’atome, c'est retracer l'histoire de la science elle-même. Chaque nouveau modèle atomique n'a pas seulement corrigé le précédent : il a ouvert la porte à des technologies révolutionnaires, de l'électricité à l'énergie nucléaire, en passant par les lasers et l'imagerie médicale.
Dans ce cours complet, nous allons décrypter ensemble chaque étape clé, analyser chaque schéma de l’atome et comprendre comment les scientifiques ont réussi à "voir" l'invisible.
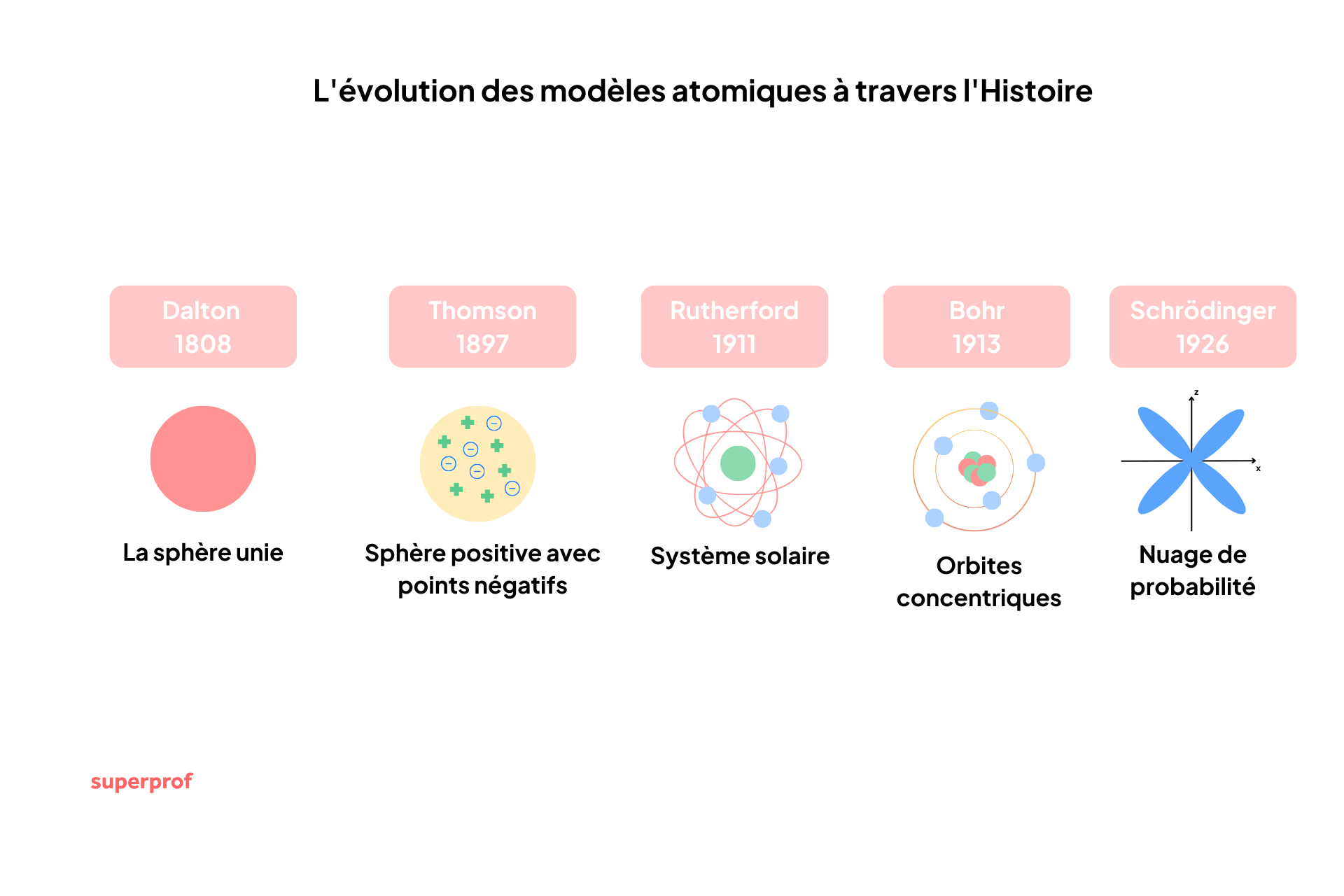
-400 av. J.-C.
Démocrite
L'atome est une brique indivisible et éternelle.
1808
John Dalton
L'atome est une sphère pleine de masse différente selon l'élément.
1897
J.J. Thomson
Découverte de l'électron et modèle du "Plum Pudding".
1911
Ernest Rutherford
Découverte du noyau et structure lacunaire.
1913
Niels Bohr
Orbites quantifiées et niveaux d'énergie.
1926
Erwin Schrödinger
Le modèle quantique de l'atome et les orbitales.
Nous avons vu ici les grandes étapes des modèles atomiques, mais l'histoire de la physique est pavée de nombreuses autres découvertes fascinantes. De la radioactivité au boson de Higgs, retrouvez tous les jalons dates par dates dans notre Chronologie: physique de l'atome et des particules.

Les premiers modèles atomiques : La philosophie avant la preuve
Bien avant de devenir une certitude scientifique, l'atome était une intuition philosophique. Durant des siècles, deux visions du monde se sont affrontées : la matière est-elle continue (divisible à l'infini) ou discontinue (constituée de grains finis) ?
Le modèle de Démocrite : L'intuition du grain de sable
Au Ve siècle avant J.-C., en Grèce antique, le philosophe Démocrite (disciple de Leucippe) ose une hypothèse audacieuse. Il imagine que si l'on coupe une pomme en deux, puis encore en deux, et ainsi de suite, il arrivera forcément un moment où l'on obtiendra un morceau si petit qu'il sera impossible de le couper davantage.

Il baptise cette particule ultime atomos, ce qui signifie en grec "qui ne peut être coupé" ou "insécable".
Selon le modèle de Démocrite :
- Les atomes sont des particules solides, invisibles et éternelles.
- Ils sont séparés par du vide (une idée révolutionnaire pour l'époque).
- Leur forme explique les propriétés de la matière : des atomes crochus pour le fer (solide), des atomes lisses et ronds pour l'eau (liquide).
Ce premier modèle atomique est fascinant car il est né de la pure réflexion, sans aucune technologie pour le prouver. C'est la naissance de la théorie atomiste.
Le modèle d’Aristote : Le frein à l'évolution scientifique
Malheureusement, cette vision avant-gardiste va être balayée par un autre géant de la pensée : Aristote. Pour lui, le vide ne peut pas exister ("La nature a horreur du vide"). Il rejette donc l'idée d'atomes séparés par du vide.

Aristote impose la théorie des quatre éléments, selon laquelle toute matière est un mélange de :
- Terre (froid et sec)
- Eau (froid et humide)
- Air (chaud et humide)
- Feu (chaud et sec)
Cette vision, soutenue plus tard par l'Église, va dominer la science occidentale pendant près de 2000 ans, bloquant l'évolution du modèle de l’atome jusqu'à la Renaissance.
La révolution scientifique des modèles atomiques
Il faut attendre le début du XIXe siècle pour que l'approche expérimentale remplace la spéculation. La chimie et la physique vont alors transformer l'hypothèse de l'atome en une réalité concrète.
Le modèle de Dalton (1808) : Le retour de l'atome
C'est le chimiste anglais John Dalton qui ressuscite l'idée de Démocrite. En étudiant les réactions chimiques et le comportement des gaz, il remarque que les éléments réagissent toujours selon des proportions de masse fixes.
Il propose alors le premier modèle atomique scientifique :
- La matière est composée de particules indivisibles appelées atomes.
- Les atomes sont des sphères pleines et dures (comme des boules de billard microscopiques).
- Tous les atomes d'un même élément (ex: Carbone) sont identiques (même masse).
- Lors d'une réaction chimique, les atomes ne disparaissent pas, ils se réarrangent (ce qui confirme la célèbre phrase de Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme").
Ce modèle simple permet d'expliquer la chimie de base, mais il ne dit rien sur ce qui se passe à l'intérieur de l'atome.
Si le modèle atomique décrit la structure interne de la matière, il est crucial de savoir ce qui différencie le Carbone de l'Oxygène. Ne confondez plus jamais ces deux notions grâce à notre fiche explicative sur les atomes et éléments.
Le modèle de Thomson (1897) : La découverte de l'électron
À la fin du XIXe siècle, une découverte majeure vient ébranler la vision de la sphère indivisible : l'électricité. Le physicien britannique J.J. Thomson étudie les rayons cathodiques et découvre qu'ils sont constitués de particules chargées négativement, environ 2000 fois plus légères que l'atome d'hydrogène. Il vient de découvrir l'électron.
C'est un choc : l'atome est divisible ! Il contient des particules plus petites. Mais comme l'atome est électriquement neutre, il doit aussi contenir une charge positive pour compenser celle des électrons.
Thomson propose le modèle du "Plum Pudding" (ou pain aux raisins) :
- L'atome est une sphère remplie d'une substance chargée positivement (la pâte).
- Les électrons (négatifs) sont incrustés dedans comme des raisins secs.
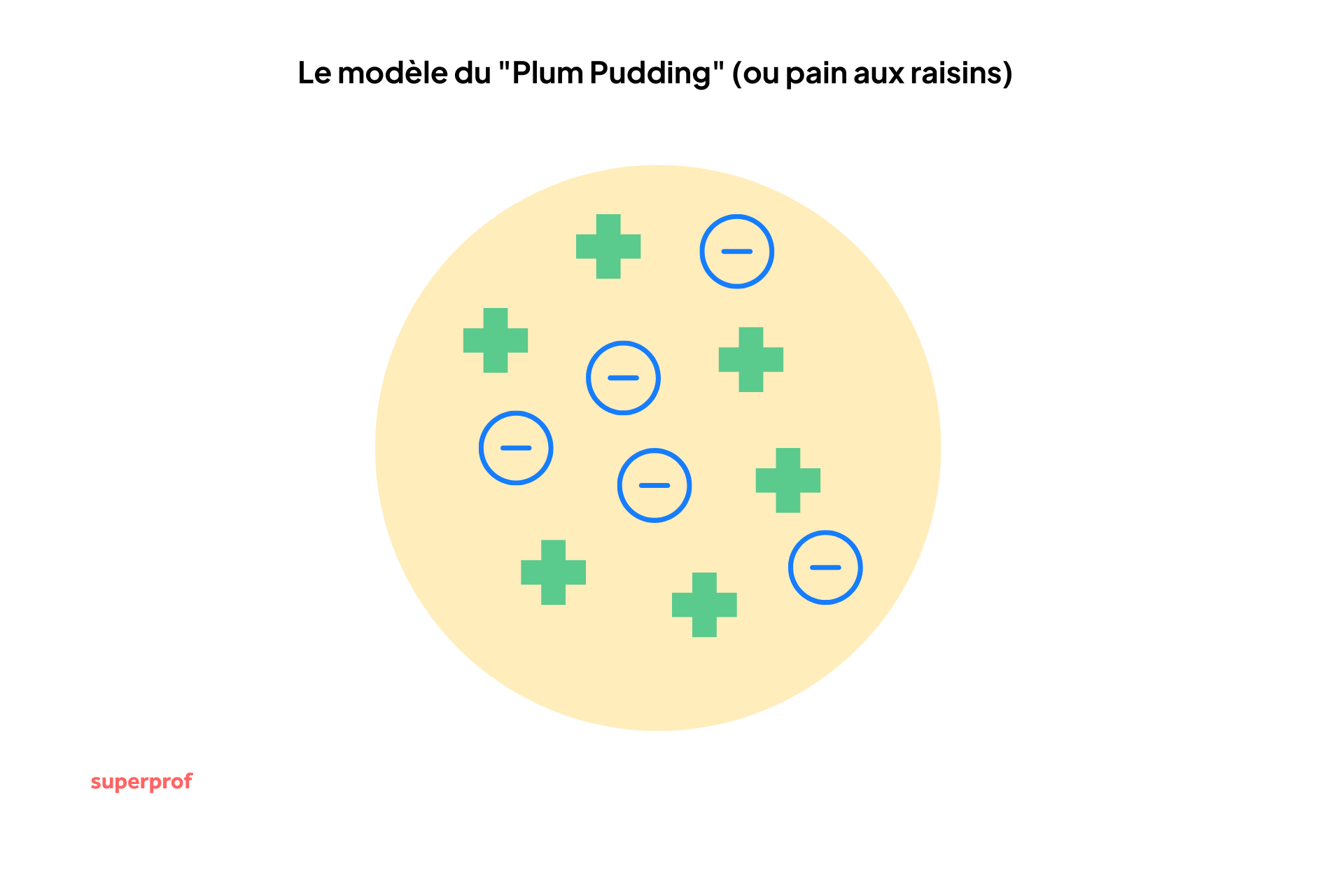
Pour la première fois, le schéma de l’atome révèle une structure interne.

Le modèle de Rutherford (1911) : La structure lacunaire
En 1911, Ernest Rutherford (un ancien élève de Thomson) réalise une expérience qui va changer la face de la physique. Il bombarde une très fine feuille d'or avec des particules alpha (chargées positivement et très rapides).
L'observation stupéfiante :
- 99,9% des particules traversent la feuille d'or sans être déviées.
- Quelques rares particules (1 sur 8000) rebondissent violemment en arrière.
La conclusion de Rutherford : Le modèle du pudding est faux. Si l'atome était une pâte pleine, toutes les particules auraient dû être ralenties. Pour expliquer ce résultat, Rutherford propose le modèle planétaire :
- L'atome est constitué essentiellement de vide (c'est la structure lacunaire).
- Toute la masse et la charge positive sont concentrées dans un point minuscule au centre : le noyau atomique.
- Les électrons tournent autour du noyau très loin, comme des planètes autour du Soleil.
Si le noyau de l'atome était une pomme posée au centre de Paris, les électrons seraient des mouches tournant au niveau du périphérique ! Tout le reste n'est que du vide.
Le modèle planétaire a révélé l'existence du noyau, mais de quoi est-il réellement constitué ? Plongez au cœur de la matière pour tout savoir sur les protons et les neutrons dans notre article sur la découverte de l'atome et sa structure.
Le modèle de Bohr (1913) : Les orbites quantifiées
Le modèle de Rutherford avait un défaut majeur : selon les lois de la physique classique, un électron en rotation devrait perdre de l'énergie et s'écraser sur le noyau en une fraction de seconde. Or, les atomes sont stables.
Le physicien danois Niels Bohr sauve le modèle en 1913 en y introduisant les débuts de la physique quantique. Dans le modèle de Bohr :
- Les électrons ne gravitent pas n'importe où, mais sur des orbites précises (appelées couches K, L, M...).
- Tant que l'électron reste sur son orbite, il ne perd pas d'énergie.
- L'électron peut "sauter" d'une orbite à une autre en absorbant ou en émettant un photon (lumière).
Ce schéma de l’atome explique parfaitement pourquoi les atomes émettent de la lumière de couleurs spécifiques (les spectres de raies), mais il montre ses limites pour les atomes plus gros que l'hydrogène.
Le modèle quantique de l’atome
L'histoire ne s'arrête pas là. Dans les années 1920, une nouvelle théorie bouleverse notre compréhension du monde : la mécanique quantique. Elle va donner naissance au modèle atomique actuel, le plus précis à ce jour.
Les fondements de la mécanique quantique
Le passage au modèle quantique de l'atome repose sur deux principes qui défient l'intuition :
La dualité onde-particule (Louis de Broglie, 1924) : L'électron n'est pas une simple bille solide. Il se comporte à la fois comme une particule et comme une onde (vibration).
Le principe d'incertitude (Werner Heisenberg, 1927) : Il est physiquement impossible de connaître à la fois la position exacte et la vitesse d'un électron. Plus on essaie de le localiser précisément, moins on connaît sa vitesse.
Conséquence directe : l'idée de "trajectoire" ou d'orbite circulaire définie par Bohr devient obsolète. On ne peut plus dire "l'électron est ici", mais seulement "il a une chance d'être ici".
L’équation de Schrödinger et les orbitales
En 1926, le physicien autrichien Erwin Schrödinger formule l'équation fondamentale qui décrit l'électron comme une fonction d'onde. C'est l'acte de naissance du modèle probabiliste.
Dans ce modèle moderne :
- Le noyau (composé de protons et de neutrons, découverts par Chadwick en 1932) reste au centre.
- Les électrons ne suivent pas des orbites, mais occupent des orbitales atomiques.
- Une orbitale est une zone de probabilité de présence. C'est un volume de l'espace où l'on a 95% de chances de trouver l'électron.
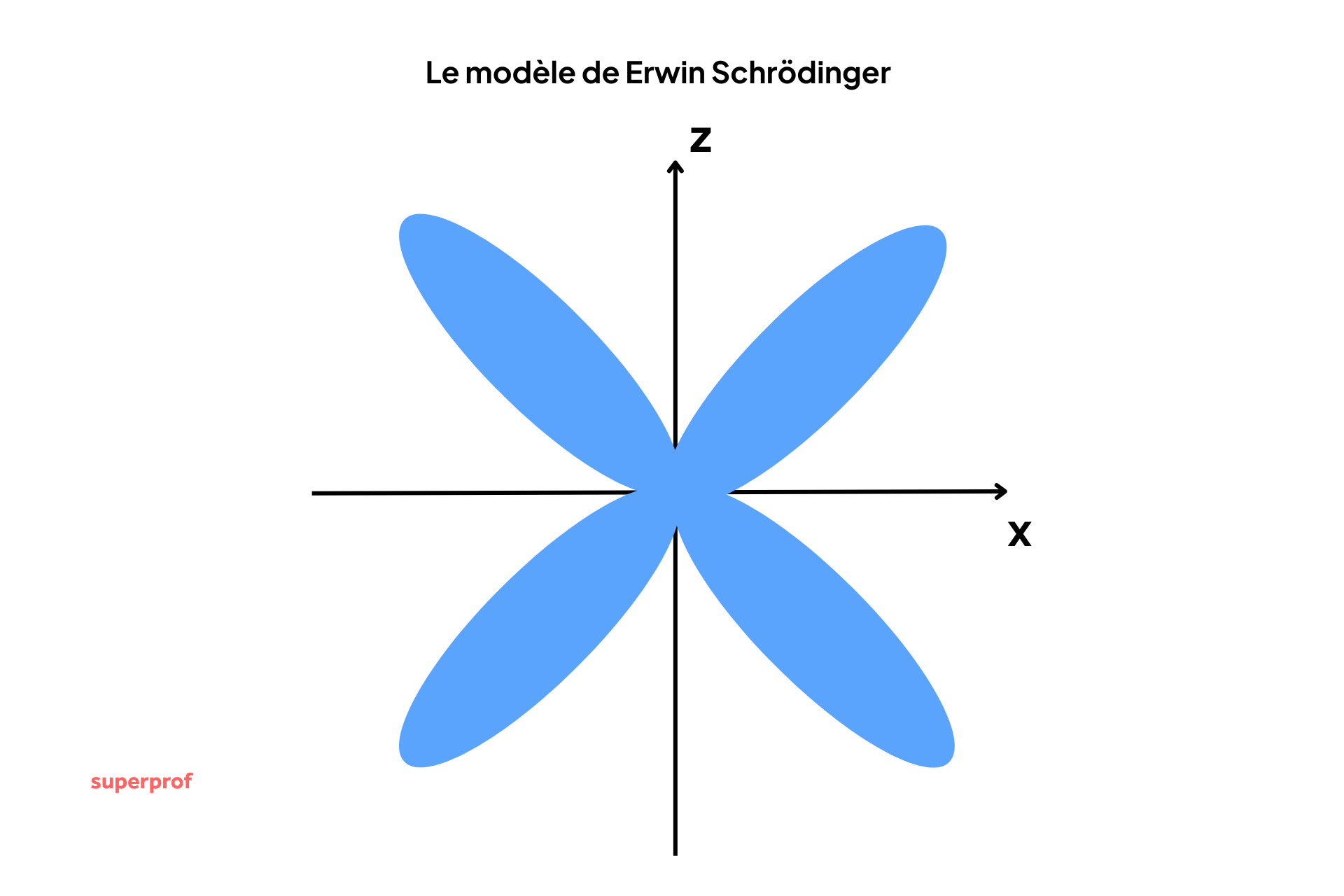
Le schéma de l’atome ne ressemble plus à un système solaire, mais plutôt à un nuage électronique diffus autour du noyau. Ce nuage est plus dense là où la probabilité de trouver l'électron est forte.
Imaginez les pales d'un ventilateur qui tourne très vite. Vous ne voyez pas les pales individuellement, mais un "flou" qui occupe tout l'espace du cercle. Le nuage électronique fonctionne un peu de la même manière.
Les applications du modèle quantique aujourd’hui
Pourquoi est-il si important de maîtriser ce modèle quantique de l’atome, si complexe soit-il ? Parce qu'il est le socle de toutes les technologies modernes.
La spectroscopie atomique
Le modèle quantique explique précisément les échanges d'énergie dans l'atome. En analysant la lumière émise ou absorbée par une substance (spectres d'émission et d'absorption), les scientifiques peuvent identifier sa composition exacte. C'est grâce à cela que nous connaissons la composition chimique des étoiles situées à des années-lumière, ou que nous pouvons détecter des polluants dans l'atmosphère.
La chimie quantique et les matériaux
Comprendre la forme des orbitales atomiques permet d'expliquer les liaisons chimiques.
- Pourquoi l'atome de carbone peut-il faire 4 liaisons ?
- Pourquoi la molécule d'eau a-t-elle une forme coudée ? La chimie quantique permet de modéliser ces interactions pour créer de nouveaux médicaments, des alliages ultra-résistants ou des nanotechnologies. Si vous lisez cet article sur un écran, c'est grâce à la maîtrise des semi-conducteurs, rendue possible par le modèle quantique.
Exercices : Testez vos connaissances sur l'atome !
Avez-vous bien assimilé l'évolution du modèle de l'atome ? Vérifions cela tout de suite.
Exercice 1 : Chronologie atomique
Remettez ces modèles dans l'ordre chronologique, du plus ancien au plus récent :
A. Modèle planétaire (Rutherford)
B. Modèle quantique (Probabiliste)
C. Modèle de la sphère pleine (Dalton)
D. Modèle du Pudding (Thomson)
E. Modèle des orbites quantifiées (Bohr)
Ce champ est requis.
Ordre correct : C D A E B
Dalton (1808)
Thomson (1897)
Rutherford (1911)
Bohr (1913)
Modèle Quantique (années 1920)
Exercice 2 : Vrai ou Faux ?
L'atome est électriquement neutre.
Veuillez sélectionner une réponse.
Vrai (Autant de protons positifs que d'électrons négatifs).
Veuillez sélectionner une réponse.
Dans le modèle de Rutherford, les électrons sont collés au noyau.
Veuillez sélectionner une réponse.
Faux (Ils gravitent autour, très loin du noyau, séparés par du vide).
Une orbitale est la trajectoire exacte de l'électron autour du noyau.
Veuillez sélectionner une réponse.
Faux (C'est une zone de probabilité de présence).
Le noyau contient des protons et des neutrons.
Veuillez sélectionner une réponse.
Vrai (Le noyau, découvert par Rutherford, a été complété par la découverte du neutron par Chadwick).
Flashcards de révision sur l'atome
Testez vos connaissances sur le modèle de l'atome ! C'est l'heure du bilan ! Vous connaissez la réponse ? Cliquez sur ✅. Sinon, cliquez sur ❌. N'oubliez pas de retourner la carte pour voir la solution !
Sources
- Basdevant, Jean-Louis. Physique Quantique. Éditions Vuibert, 2017. Consulté le 12 Décembre 2025.
- CEA. "La structure de la matière." Commissariat à l'énergie atomique et aux énergies alternatives (CEA), www.cea.fr. Consulté le 12 Décembre 2025.
- Ministère de l'Éducation Nationale. "Programme de physique-chimie de seconde générale et technologique." Bulletin officiel de l'éducation nationale, 2019, www.education.gouv.fr. Consulté le 12 Décembre 2025.
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !