Chapitres

Historique du tableau périodique : de Döbereiner à Moseley
La quête pour organiser les éléments chimiques selon leurs propriétés est ancienne, mais elle a connu ses plus grandes avancées au XIXe siècle.
Saint-Pétersbourg, 17 février 1869. Dmitri Mendeleïev se réveille en sursaut dans l'aube glaciale de son appartement de la rue Tchkalov. Trois jours et trois nuits qu'il n'a pas dormi, obsédé par un problème insoluble : comment ranger logiquement les 63 éléments chimiques connus ? Son bureau disparaît sous les cartes d'éléments qu'il a découpées, réarrangées, repositionnées des centaines de fois. Mais cette nuit-là, dans un demi-sommeil épuisé, tout s'est ordonné. « J'ai vu en rêve un tableau où tous les éléments tombaient à leur place », racontera-t-il plus tard.
Les mains tremblantes – de fatigue ou d'excitation, impossible à dire – il attrape son carnet de notes relié de cuir brun. Les gribouillis qui suivent sont frénétiques : des colonnes verticales traversées de flèches, des symboles chimiques griffonnés de travers (H, Li, Be, C, N, O…), des points d'interrogation énormes pour les éléments manquants, des accolades reliant les familles. Le trait est nerveux, imprécis, certains caractères à peine lisibles. On devine l'urgence de celui qui craint de perdre une vision fugace.
Au bas de la page, une note sibylline en russe :
« Les propriétés des éléments sont fonction périodique de leur poids atomique ».
Dix-sept mots qui changeront la chimie pour toujours.

Derrière l'élégance du tableau périodique moderne se cachent des mois de recherches acharnées, immortalisées dans ces notes manuscrites.
Les pionniers avant Mendeleïev
Vers 1820, le chimiste allemand Johann Wolfgang Döbereiner propose les triades de Döbereiner, regroupant des éléments par groupes de trois possédant des propriétés chimiques comparables. C'était la première tentative pour construire un tableau des éléments.
En 1862, Alexandre-Émile Béguyer de Chancourtois classe les éléments pour la première fois selon leur masse atomique dans une structure hélicoïdale appelée la vis tellurique. Ce fut la première tentative de représenter périodiquement les éléments.
Un peu plus tard, John Alexander Reina Newlands publie un tableau et formule la loi des octaves, selon laquelle les propriétés chimiques des éléments se répètent tous les huit éléments.
Dmitri Ivanovitch Mendeleïev : le père de la classification
C’est en 1869 que le chimiste russe Dmitri Ivanovitch Mendeleïev présente sa classification, inspirée par ses prédécesseurs. Son tableau est novateur, car il est la première tentative réussie d'organiser les 63 éléments connus à l'époque selon leurs propriétés chimiques et leurs masses atomiques.
Le tableau périodique est un outil essentiel en chimie, utilisé pour prédire le comportement des éléments, leurs réactions chimiques, et pour comprendre la structure électronique des atomes.
💡 L'innovation Clé
Sa vision novatrice s'est exprimée par le fait qu'il a laissé des espaces vides pour des éléments non découverts, ce qui lui a permis de prédire avec précision leurs propriétés.
Principes Fondateurs de sa Théorie
Les principes clés de sa théorie stipulaient que :
- Les propriétés des éléments sont périodiques lorsqu'ils sont rangés selon leur masse atomique.
- Le caractère de l'élément est fonction de l'importance de cette masse atomique.
La révolution de Henry Moseley
En 1913, Henry Moseley apporta une révolution essentielle en classant les éléments non plus par masse atomique, mais par numéro atomique (Z) croissant. Cette modification a permis d'expliquer et de corriger certaines anomalies observées dans le tableau de mendeleïev. Le numéro atomique  correspond au nombre de protons dans le noyau d'un atome.
correspond au nombre de protons dans le noyau d'un atome.
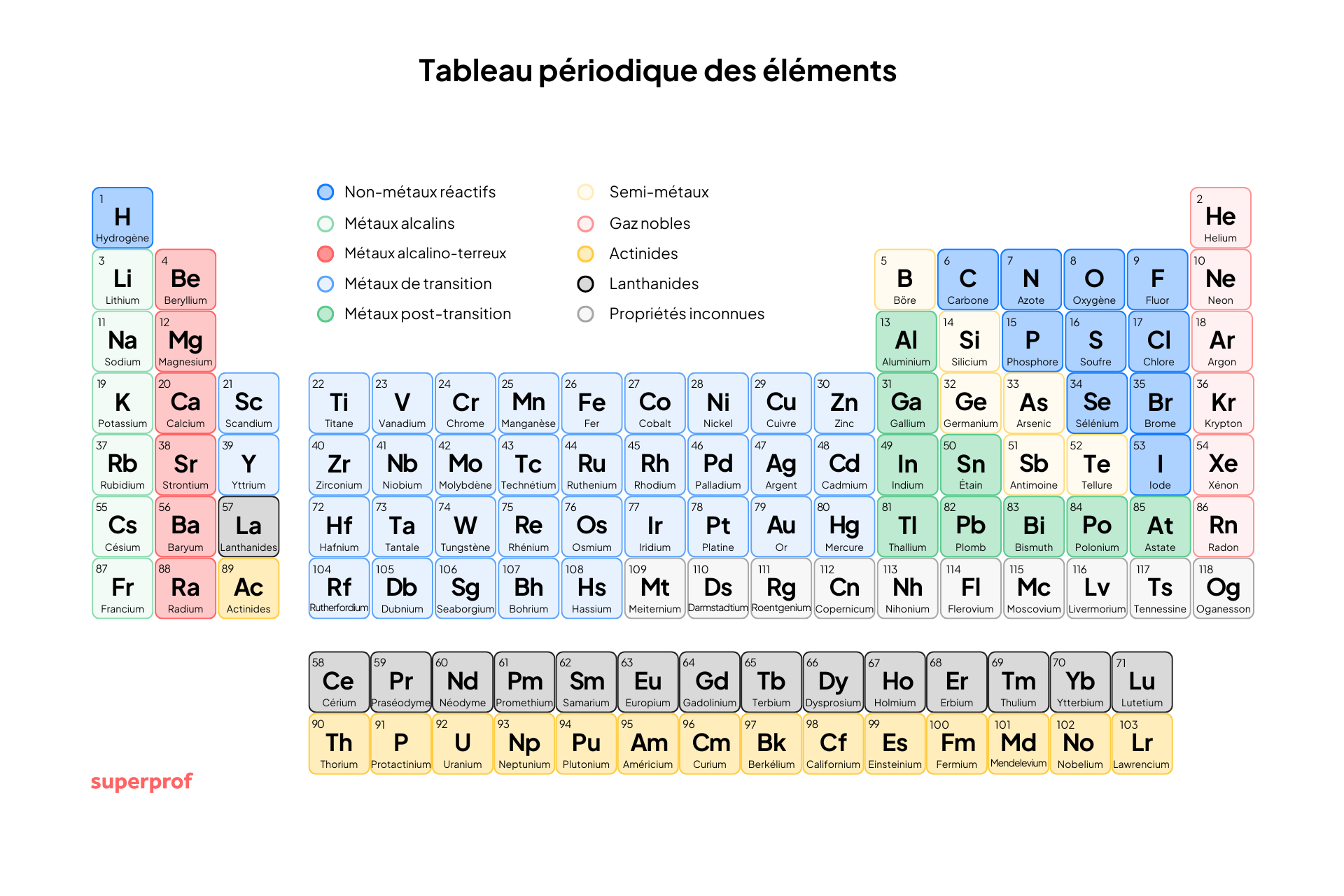
Structure et principe de la classification périodique actuelle
La classification périodique actuelle, mise à jour pour la dernière fois par l'Union Internationale de Chimie Pure et Appliquée (UICPA), repose sur l'organisation par numéro atomique croissant. Elle comporte 118 éléments au total, dont 83 sont primordiaux (plus anciens que la terre) et 35 sont synthétiques (fabriqués par l'homme).
La structure du tableau est définie par la configuration électronique des atomes.
Périodes (lignes) et groupes (colonnes)
- Les périodes sont les 7 lignes horizontales du tableau. La période d'un élément est déterminée par son nombre de couches électroniques (ou nombre quantique principal
 ). Par exemple, les éléments de la deuxième période ont deux couches électroniques (K et L) dont la couche externe est L.
). Par exemple, les éléments de la deuxième période ont deux couches électroniques (K et L) dont la couche externe est L. - Les groupes (ou familles) sont les 18 colonnes verticales. Les éléments d'un même groupe possèdent le même nombre d’électrons sur leur couche externe. Ce critère est essentiel, car le nombre d'électrons de valence détermine la réactivité et les propriétés chimiques similaires des éléments.

Classification et structure électronique
La position d'un élément dans le tableau permet de déduire sa configuration électronique, et inversement.
- Exemple du carbone (
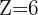 ) : Il est situé sur la deuxième période (couche externe L) et dans la quatrième colonne (4 électrons de valence). Sa configuration électronique est donc
) : Il est situé sur la deuxième période (couche externe L) et dans la quatrième colonne (4 électrons de valence). Sa configuration électronique est donc 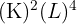 .
. - Exemple du magnésium (
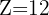 ) : Sa configuration électronique est
) : Sa configuration électronique est 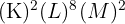 . Sa couche externe est la troisième (M), il est donc dans la troisième période. Il possède deux électrons de valence, il est donc dans la deuxième colonne.
. Sa couche externe est la troisième (M), il est donc dans la troisième période. Il possède deux électrons de valence, il est donc dans la deuxième colonne.
Le tableau périodique est construit selon les propriétés physico-chimiques des éléments. Ces propriétés dépendent de la configuration électronique de chaque élément.
Chaque ligne du tableau, appelée période, correspond à une couche électronique caractérisée par le nombre quantique principal (n).
Il existe sept couches électroniques à l’état fondamental → donc 7 périodes dans le tableau standard.
Chaque période est divisée en blocs (de 1 à 4 selon la période) correspondant aux sous-couches électroniques.
Ces sous-couches sont identifiées par le nombre quantique secondaire (ℓ), et notées s, p, d, f (d’après la spectroscopie).
Nombre d’orbitales atomiques par sous-couche :
s → 1 orbitale
p → 3 orbitales
d → 5 orbitales
f → 7 orbitales
Chaque orbitale est définie par un nombre quantique magnétique (mℓ). Chaque orbitale peut contenir au maximum deux électrons, différenciés par leur nombre quantique de spin (ms).
Les grandes familles d'éléments et leurs propriétés périodiques
Les groupes principaux du tableau de Mendeleïev ⚗️
➡️ Les éléments dans une même colonne (groupe) partagent des propriétés chimiques similaires en raison de la similarité de leur configuration électronique.
Les groupes principaux sont généralement étiquetés
- Groupe 1 : Métaux alcalins : Très réactifs, ils possèdent un électron de valence. Ils forment des cations en perdant cet électron (ex :
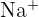 ). Ils sont mous et brillants.
). Ils sont mous et brillants. - Groupe 2 : Métaux alcalino-terreux : Moins réactifs que le groupe 1, ils possèdent deux électrons de valence. Ils forment des cations en perdant deux électrons (ex :
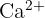 ). Leur nom vient de leur capacité à résister au feu.
). Leur nom vient de leur capacité à résister au feu. - Groupes 3 à 12 : Métaux de transition : Famille nombreuse avec une configuration électronique complexe. Ce sont des métaux qui conduisent l’électricité et présentent une grande variété de couleurs (ex : or, titane, cuivre).
- Groupe 17 : Halogènes : Éléments très réactifs. Il leur manque un électron pour compléter leur couche externe. Ils forment des anions en gagnant un électron (ex :
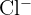 ).
). - Groupe 18 : Gaz nobles (ou gaz rares) : Éléments inertes, stables et très peu réactifs. Ils possèdent une couche externe complète (règles du duet ou de l'octet), ne forment pas d’ions et ne participent pas facilement aux molécules.
- Autres familles : On distingue aussi les lanthanides et les actinides (des métaux radioactifs et lourds, comme l'uranium, dont le mendélévium rend hommage à mendeleïev), les métaux pauvres (souvent mous et fragiles) et les métalloïdes (qui ont des propriétés intermédiaires entre les métaux et les non-métaux).

Structure du tableau de Mendeleïev 🧮
Numéro atomique (Z): le numéro atomique est le nombre de protons dans le noyau d'un atome. Les éléments sont arrangés dans l'ordre croissant de leur numéro atomique.
Symboles chimiques: chaque élément a un symbole chimique unique, souvent une ou deux lettres, utilisé pour représenter cet élément.
Masse atomique: La masse atomique est la masse moyenne des isotopes d'un élément, exprimée en unités de masse atomique (uma).
| Numéro atomique | Symbole | Nom | Masse Atomique |
|---|---|---|---|
| 1 | H | Hydrogène | 1.008 |
| 2 | He | Hélium | 4.0026 |
| 3 | Li | Lithium | 6.94 |
| 4 | Be | Béryllium | 9.0122 |
| 5 | B | Bore | 10.81 |
| 6 | C | Carbone | 12.011 |
| 7 | N | Azote | 14.007 |
| 8 | O | Oxygène | 15.999 |
| 9 | F | Fluor | 18.998 |
| 10 | Ne | Néon | 20.180 |
| 11 | Na | Sodium | 22.990 |
| 12 | Mg | Magnésium | 24.305 |
| 13 | Al | Aluminium | 26.982 |
| 14 | Si | Silicium | 28.085 |
| 15 | P | Phosphore | 30.974 |
| 16 | S | Soufre | 32.06 |
| 17 | Cl | Chlore | 35.45 |
| 18 | Ar | Argon | 39.948 |
| 19 | K | Potassium | 39.098 |
| 20 | Ca | Calcium | 40.078 |
| 21 | Sc | Scandium | 44.956 |
| 22 | Ti | Titane | 47.867 |
| 23 | V | Vanadium | 50.942 |
| 24 | Cr | Chrome | 51.996 |
| 25 | Mn | Manganèse | 54.938 |
| 26 | Fe | Fer | 55.845 |
| 27 | Co | Cobalt | 58.933 |
| 28 | Ni | Nickel | 58.693 |
| 29 | Cu | Cuivre | 63.546 |
| 30 | Zn | Zinc | 65.38 |
| 31 | Ga | Gallium | 69.723 |
| 32 | Ge | Germanium | 72.630 |
| 33 | As | Arsenic | 74.922 |
| 34 | Se | Sélénium | 78.971 |
| 35 | Br | Brome | 79.904 |
| 36 | Kr | Krypton | 83.798 |
| 37 | Rb | Rubidium | 85.468 |
| 38 | Sr | Strontium | 87.62 |
| 39 | Y | Yttrium | 88.906 |
| 40 | Zr | Zirconium | 91.224 |
| 41 | Nb | Niobium | 92.906 |
| 42 | Mo | Molybdène | 95.95 |
| 43 | Tc | Technétium | 98.0 |
| 44 | Ru | Ruthénium | 101.07 |
| 45 | Rh | Rhodium | 102.91 |
| 46 | Pd | Palladium | 106.42 |
| 47 | Ag | Argent | 107.87 |
| 48 | Cd | Cadmium | 112.41 |
| 49 | In | Indium | 114.82 |
| 50 | Sn | Étain | 118.71 |
| 51 | Sb | Antimoine | 121.76 |
| 52 | Te | Tellure | 127.60 |
| 53 | I | Iode | 126.90 |
| 54 | Xe | Xénon | 131.29 |
| 55 | Cs | Césium | 132.91 |
| 56 | Ba | Baryum | 137.33 |
| 57-71 | * | Lanthanides | |
| 72 | Hf | Hafnium | 178.49 |
| 73 | Ta | Tantale | 180.95 |
| 74 | W | Tungstène | 183.84 |
| 75 | Re | Rhénium | 186.21 |
| 76 | Os | Osmium | 190.23 |
| 77 | Ir | Iridium | 192.22 |
| 78 | Pt | Platine | 195.08 |
| 79 | Au | Or | 196.97 |
| 80 | Hg | Mercure | 200.59 |
| 81 | Tl | Thallium | 204.38 |
| 82 | Pb | Plomb | 207.2 |
| 83 | Bi | Bismuth | 208.98 |
| 84 | Po | Polonium | 209.98 |
| 85 | At | Astate | 210.0 |
| 86 | Rn | Radon | 222.0 |
| 87 | Fr | Francium | 223.0 |
| 88 | Ra | Radium | 226.0 |
| 89-103 | ** | Actinides | |
| 104 | Rf | Rutherfordium | 267.0 |
| 105 | Db | Dubnium | 270.0 |
| 106 | Sg | Seaborgium | 271.0 |
| 107 | Bh | Bohrium | 270.0 |
| 108 | Hs | Hassium | 277.0 |
| 109 | Mt | Meitnerium | 276.0 |
| 110 | Ds | Darmstadtium | 281.0 |
| 111 | Rg | Roentgenium | 280.0 |
| 112 | Cn | Copernicium | 285.0 |
| 113 | Nh | Nihonium | 284.0 |
| 114 | Fl | Flerovium | 289.0 |
| 115 | Mc | Moscovium | 288.0 |
| 116 | Lv | Livermorium | 293.0 |
| 117 | Ts | Tennessine | 294.0 |
| 118 | Og | Oganesson | 294.0 |
Entre 2004 et 2010, quatre nouveaux éléments ont été identifiés et validés par l'Union internationale de chimie pure et appliquée (IUPAC).
Il s'agit de l'ununtrium (Uut), découvert en 2003 et confirmé par l'IUPAC en 2015, suivi de l'ununquadium (Uuq), découvert en 2004 et confirmé en 2016.
L'ununpentium (Uup) a été découvert en 2004 et sa confirmation officielle par l'IUPAC a eu lieu en 2013.
Enfin, l'ununhexium (Uuh), découvert entre 2000 et 2002, a été validé par l'IUPAC en 2011.
Tendances des propriétés périodiques
Les tendances des propriétés des éléments varient de façon prévisible dans le tableau :
| Le long d'une Période (De gauche à droite) | Le long d'un Groupe (De haut en bas) |
|---|---|
| La taille atomique diminue. | La taille atomique augmente. |
| L'énergie d'ionisation (énergie nécessaire pour retirer un électron) augmente. | L'énergie d'ionisation diminue. |
| L'électronégativité (capacité à attirer les électrons) augmente. | L'électronégativité diminue. |
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Nombre de charge
Bonjour Yann, bravo pour vos écrits. Je vous invite à corriger deux coquilles :
1) une faute « Dmitri Mendeleïev travailla sur de nombreuses autres domaine » : nombreux
2) retour à la ligne après « ne pouvait y être placé. M »
Belle journée à vous
Pierre
Thank you for articles. congratulations.
I wonder the U shape of the table.
I want to know How can we make real chemicals in life please
des articles trés mesuré riche de savoir faire utile
nous devons formuler cette bibiliothéque sous forme de résumé