Chapitres

Composition des solutions aqueuses ?
Pour pouvoir fabriquer une solution aqueuse, encore faut-il connaître les différents composants d'une solution, à savoir :
- Le solvant et soluté (parmi lesquels on retrouve le liquide, gaz ou solide)
- L'eau comme base universelle
Découvrez-en plus dans cette partie introductive !

Solvant et soluté
? Lorsque l'on parle de solutions aqueuses, il est essentiel de comprendre les deux composants qui les constituent :
Le solvant, qui est le composé dans lequel le soluté est dissous (généralement, c'est l'eau)
Le soluté, qui se disperse au contact du solvant dans la solution
Généralement, dans le cas des solutions aqueuses, le solvant est l'eau. Le solvant est souvent présent en plus grande quantité que le soluté et joue un rôle crucial dans la formation de la solution. Sa capacité à dissoudre le soluté repose sur des interactions intermoléculaires telles que les liaisons hydrogène.
Lorsque le soluté est ajouté au solvant et que les interactions entre les molécules du soluté et celles du solvant sont suffisamment fortes, le soluté se disperse uniformément dans le solvant pour former une solution homogène.
Solvant universel : l'eau
? L'eau est souvent appelée le "solvant universel" en raison de sa capacité exceptionnelle à dissoudre un large éventail de substances chimiques
Cette caractéristique unique est due à la structure moléculaire de l'eau. Une molécule d'eau est constituée de :
- Deux atomes d'hydrogène reliés à un atome d'oxygène par des liaisons covalentes
- Les atomes d'oxygène sont plus électronégatifs que les atomes d'hydrogène, créant ainsi une distribution inégale des charges électriques dans la molécule d'eau, rendant ainsi la molécule polaire.
- Cette polarité permet à l'eau d'interagir avec d'autres substances polaires ou ioniques, telles que les sels et les sucres, et de les dissoudre facilement
? Grâce à cette capacité, l'eau joue un rôle fondamental dans les processus biologiques, l'industrie, la chimie et bien d'autres domaines.
Solides, liquides et gaz comme solutés
Les solutés dans les solutions aqueuses peuvent être sous différentes formes de la matière :
Solides
Liquides
Gaz
? Les solides sont les solutés les plus courants dans les solutions aqueuses, car de nombreux solides sont solubles dans l'eau.
Par exemple, le sel de cuisine (chlorure de sodium) se dissout facilement dans l'eau pour former une solution saline
Les liquides peuvent également être des solutés, bien que leur solubilité dans l'eau puisse varier considérablement. Les gaz, quant à eux, peuvent également se dissoudre dans l'eau, bien que leur solubilité dépende de facteurs tels que la pression et la température.
Par exemple, le dioxyde de carbone (CO2) se dissout dans l'eau pour former de l'eau gazeuse. La capacité de l'eau à dissoudre des solides, des liquides et des gaz la rend extrêmement polyvalente et lui permet d'agir comme un milieu de réaction, de transport et de dissolution dans une variété d'applications pratiques et industrielles.
Définition d'une solution aqueuse ?

Une solution est un mélange homogène obtenu en dissolvant une ou plusieurs espèces chimiques appelées les solutés, dans un liquide que l'on appelle le solvant.
Au cours de la dissolution, le soluté va se disperser progressivement dans le solvant jusqu'à ce que l'ensemble forme un mélange homogène que l'on appelle la solution. Concrètement, deux phases se sont mélangées. Lorsque le soluté n'est plus visible à l’œil nu, il s'est complètement dissout dans le solvant : il ne reste alors qu'une unique phase.
Le choix du solvant dépend fortement du soluté avec lequel il va être mélangé :
- Plus la dissolution est importante, meilleur est le solvant.
- À noter que la dissolution peut se faire naturellement, mais il faut aussi parfois aider et accélérer cette dissolution en chauffant le mélange ou bien en l'agitant
✅ Quelques exemples :
- Le sucre (= soluté solide) et l'eau (= solvant) forment un bon couple soluté/solvant car leur mélange forme une unique phase.
- En revanche, l'huile (= soluté liquide) et l'eau (= solvant) ou encore le sable (= soluté solide) et l'eau (= solvant) ne forment pas de bons couples soluté/solvant puisque dans chaque cas, les deux phases ne se mélangent pas.
On parle alors de mélanges non homogènes.
? Remarque : dans le cas de deux liquides en solution, le solvant est toujours le liquide présent en plus grande quantité, tandis que le soluté est le liquide minoritaire
Définition d'une solution aqueuse
Ainsi, compte-tenu des éléments définis plus haut, une solution aqueuse est tout simplement une solution dans laquelle un ou plusieurs solutés (sous forme solide, liquide ou gazeuse) sont dissous dans de l'eau (= le solvant) pour former un mélange homogène.
Notez que l'eau est le solvant qui permet de former des solutions aqueuses. Cependant, il existe de nombreux autres solvants. Par exemple, en utilisant de l'alcool comme solvant, on obtient alors une solution alcoolique.
Quelques exemples de solutions aqueuses ?
- L'eau sucrée est une solution aqueuse dont le solvant est l'eau et le soluté est le sucre
- L'eau salée est une solution aqueuse dont le solvant est l'eau et le soluté est le sel
- L'eau minérale est une solution aqueuse dont le solvant est l'eau et les solutés sont les sels minéraux (les ions calcium, potassium, magnésium etc.)
- La limonade est une solution aqueuse dont le solvant est l'eau et les principaux solutés sont le sucre, l'acide citrique et de dioxyde de carbone.
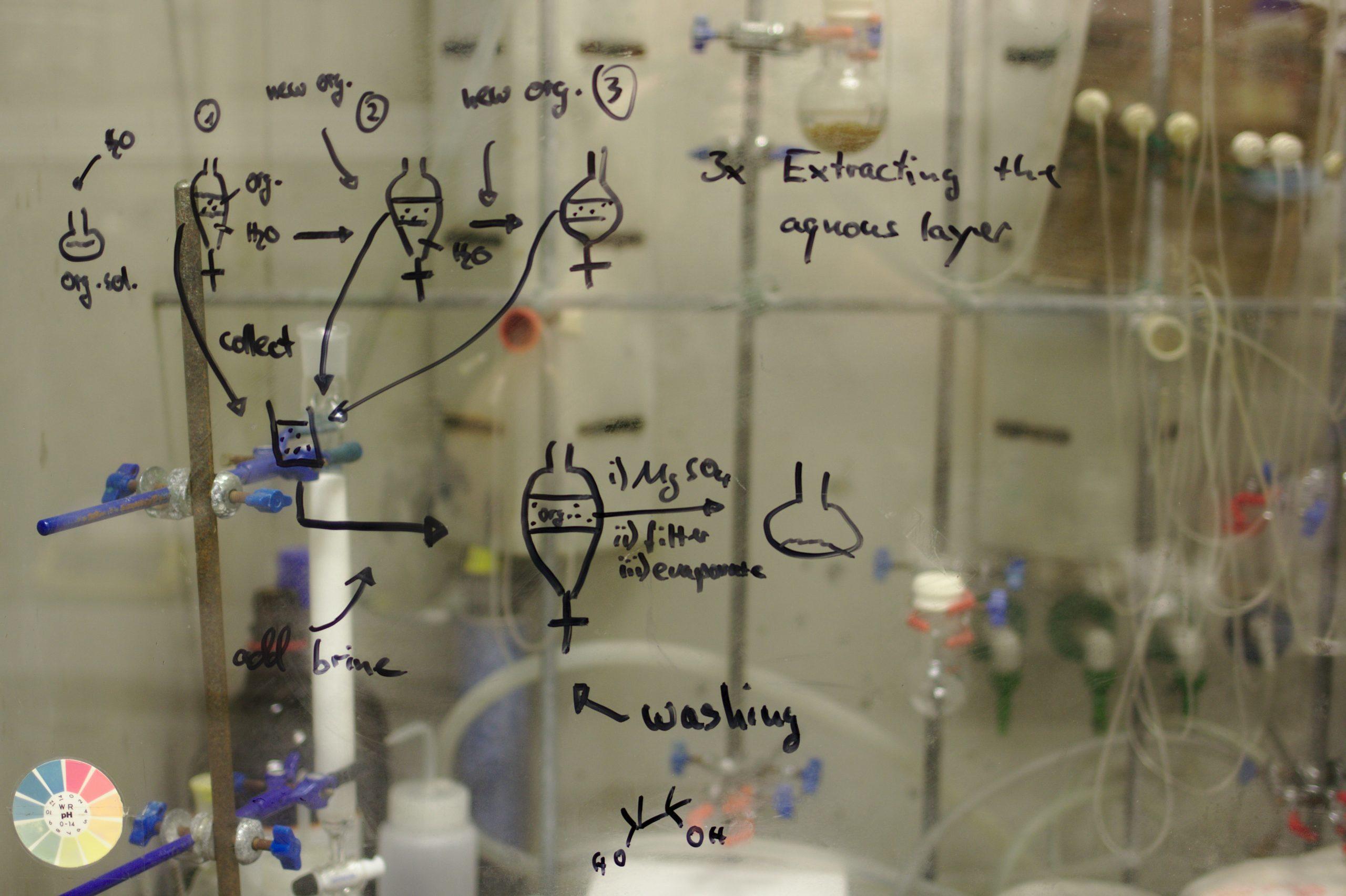
Les solutions aqueuses ioniques et moléculaires
En fonction de la nature du soluté, on peut parler de solution aqueuse ionique ou de solution aqueuse moléculaire.
Une transformation chimique est la transformation d'espèces chimiques appelées réactifs en d'autres espèces chimiques appelées produits. Cette transformation s'opère par un réarrangement des éléments chimiques :
- Les entités entrantes en réaction ( réactifs ) vont se casser par rupture de certaines liaisons et libérer des éléments chimiques ou groupes d'élément chimiques
- Ces éléments ou groupes vont se combiner entre eux en formant de nouvelles liaisons donc de nouvelles espèces chimiques appelées produits
- On peut dès lors écrire un schéma globale d'une transformation chimique
⚠️ Attention ! Un changement d'état n'est pas une transformation chimique mais une transformation physique
Lors d'une réaction chimique, l'énergie a pour habitude de diminuer. En effet, la réaction et donc l'accrochage des atomes entre eux consomme de l'énergie. L'énergie consommée par les atomes s'appelle l'énergie de liaison. Cette énergie est créée lorsque deux atomes se combinent. Ils la libèrent alors. Pour que la réaction puisse avoir lieu, il faut que l'énergie au moment où les liaisons sont cassées et que les nouvelles ne sont pas encore créées ne soit pas trop importante. Cette barrière énergétique s'appelle l'énergie d'activation.
⚡️ Dans le cadre d'une réaction chimique à température et pression constantes, on peut mesurer l'énergie au sein de la réaction grâce à une fonction :
Celle-ci s'appelle l'enthalpie et se note H
Définition des ions
? Un ion est un atome, qui a perdu ou gagné un ou plusieurs électrons (au maximum 3) :
- Le lithium (Li) perd un électron il devient l'ion de lithium (Li+)
- Le fluor (F) gagne un électron, il devient l'ion de fluor (F- )
- Si un atome perd 2 électrons, imaginons que cette atome soit l'hydrogène (H), il devient l'ion d'hydrogène (H+2)
Un atome (ou groupe d'atomes) qui perd un ou plusieurs électrons devient une espèce chimiquement chargée appelée ion. La charge du noyau reste inchangée :
Un ion négatif est un atome (ou groupe d'atome) qui à gagné un ou plusieurs électrons. On l'appelle "anion"
Un ion positif est un atome (ou groupe d'atome) qui à perdu un ou plusieurs électrons. On l'appelle "cation"
? Les cristaux ioniques sont constitués d'anions et de cations tenus entre eux par l'attraction électrique. Cette attraction est responsable de la structure géométrique qu'adoptent les ions pour former un cristal. Un ion positif va s'entourer d'ions négatifs et réciproquement et de la même manière que les atomes ou molécules forment les solides, les ions forment les cristaux.
Exemple : Dans un cristal de chlorure de sodium NaCl, les ions adoptent une structure cubique où un anion est entouré de 6 cations. Un cristal ionique est toujours électriquement neutre donc il y a autant de charges positives que négatives. Par conséquent, certains cristaux possèdent plus d'anions et de cations (ou inversement).
Les ions étant jointifs, la distance qui les sépare correspond à la distance entre leur centre. La cohésion du cristal est due à l'interaction coulombienne qui correspond à la force qui lie deux ions. La valeur de cette force peut paraître faible mais elle est bien plus importante par rapport au poids de l'ion. A cette échelle, c'est la force électrique qui domine. La température de fusion des solides ioniques est assez élevée (801 °C) pour le sel, ce qui veut dire que les liaisons entre ions sont très solides.
Les solutions aqueuses ioniques
? Une solution aqueuse est dite "ionique" si les espèces chimiques qui se dissolvent dans l'eau (= le solvant) sont des ions
Ces ions peuvent provenir directement du soluté, ou alors peuvent aussi être issus de la réaction du soluté avec l'eau. Lors de la dissolution, les molécules d'eau vont séparer les cations (= ions positifs) et les anions (= ions négatifs) se trouvant dans le soluté ionique. Ces derniers vont alors progressivement se disperser parmi les molécules d'eau jusqu'à ce que la solution forme un mélange homogène.
? Par exemple, le mélange entre le sel et l'eau est une solution aqueuse ionique
En effet, le sel, chimiquement désigné par le nom Chlorure de sodium (NaCl), est composé d'ions Na+ et d'ions Cl-. Une fois mis en solution dans l'eau, ces ions Na+ et Cl- vont se disperser dans l'eau. Schématiquement, l'équation bilan de la dissolution du Chlorure de sodium dans l'eau s'écrira de la façon suivante :
\[ Na Cl (s) \rightarrow Na + (aq) + Cl - (aq) \]
où :
- "s" signifie solide
- "aq" signifie aqueux
- Mettant en évidence que les ions Na+ et Cl- se trouvent désormais dans l'eau
Une solution aqueuse ionique est toujours électriquement neutre. Cela signifie que les charges positives des cations vont s'équilibrer avec les charges négatives des anions pour donner un bilan électriquement neutre. Si l'on reprend l'exemple de la dissolution du Chlorure de sodium, on constate que l'ion Na+ porte une charge positive tandis que l'ion Cl- porte une charge négative. Cela nous donne alors une charge positive et une charge négative : la charge globale est donc nulle et la solution est électriquement neutre.
Les solutions aqueuses moléculaires
Définition : une solution aqueuse est dite "moléculaire" si les espèces chimiques qui se dissolvent dans l'eau (= le solvant) sont des molécules. Schématiquement, au cours de la dissolution, les molécules du soluté vont petit à petit se disperser dans le solvant jusqu'à ce que la solution devienne complètement homogène.
Tout comme les solutions aqueuses ioniques, les solutions aqueuses moléculaires sont également électriquement neutres. En effet, les molécules de soluté ainsi que les molécules d'eau sont neutres car elles ne sont pas porteuses de charges. Le mélange est donc électriquement neutre. A noter que les solutions aqueuses moléculaires, en l'absence d'ions, ne conduisent pas le courant.
L'électrolyse d'une solution aqueuse
C'est en 1800 que la toute première électrolyse a été réalisée par deux chimistes originaires de Londres, William Nicholson et Sir Anthony Carlisle. Ils réalisent une électrolyse de l'eau.
L'électrolyse met en jeu deux couples rédox. Il les fait réagir dan le sens contraire de la réaction naturelle au moyen d'un courant électrique qui apporte l'énergie nécessaire à la réaction.
Un électrolyseur est un dispositif consistant en une récipient contenant une solution ionique dans la quelle plongent deux électrodes.
Une électrolyse est une opération chimique dont le but est de décomposer différentes matières. Par exemple, lorsqu'une solution contient une matière, on va y ajouter un solvant afin que ses ions soit décomposables. On plonge alors ce mélange dans un bain auquel sont intégrés une anode et une cathode, faisant alors passer un courant dans le bain.
Les électrodes se polarisent dès que le courant passe :
- L'anode est l'électrode par laquelle le courant arrive dans le système. Les électrons en sortent donc. Il y a oxydation du réducteur. Elle est reliée au pôle + du générateur.
- La cathode est l'électrode par laquelle sort le courant c'est à dire par laquelle entrent les électrons. Il s'y produit. Elle est reliée au pôle - du générateur.
Contrairement aux piles vues dans le chapitre sur le potentiel standard, le dispositif d'électrolyse n'est pas polarisé par les couples rédox mais bien par le générateur branché à ses bornes.
- L'électrolyte est le milieu conducteur, la solution ionique dans laquelle baignent les anions et les cations
- Les anions de l'électrolyte migrent vers l'électrode reliée au pôle + ( l'anode) et y subissent parfois une réaction d'oxydation
- Les cations de l'électrolyte migrent vers l'électrode reliée au pôle - ( c'est à dire la cathode)où ils peuvent subir une réduction
- Il peut enfin y avoir éventuellement oxydation ou réduction de l'eau (voir ci-dessous les couples rédox de l'eau)
Les participants potentiels aux échanges électroniques sont donc :
- Les ions positifs ou négatifs du bain électrolytique ;
- Les molécules du solvant ;
- Les matériaux constituant les électrodes.
L'électron est donc l'un des composants de l'atome au même titre que les neutrons et protons. C'est une particule élémentaire que l'on note petit e et dont la charge élémentaire est de signe négatif. Ils s'organisent autour du noyau de l'atome dans ce que l'on appelle un nuage électronique.
? Les électrons et leurs propriétés ont aidé à la compréhension d'une multitude de phénomènes physiques, notamment en termes de conductivité.
Préparation d'une solution aqueuse ??
Il existe deux principaux modes de préparation d'une solution aqueuse : la préparation par dissolution dans l'eau, et la préparation par dilution dans l'eau.
Préparation par dissolution dans l'eau
Tout simplement, cela consiste à dissoudre une masse m de soluté dans un volume V de solvant.
Préparation par dilution dans l'eau

? Cette méthode de préparation d'une solution aqueuse consiste à prélever un volume V0 de concentration C0 d'une solution que l'on appelle la solution mère, puis à la diluer en ajoutant de l'eau distillée pour obtenir une solution "fille" de volume V1 et à la concentration souhaitée C1. Cette solution fille est alors moins concentrée que la solution mère puisque l'on a rajouté de l'eau à la solution mère.
Dans l'exemple de la photo ci-dessus, la solution mère parfaitement homogène est la solution la plus à gauche. Plus on se déplace vers la droite, plus on a ajouté d'eau à la solution mère, donc plus la solution mère est diluée et donc moins elle est concentrée. Cela se traduit ici par une diminution de l'intensité de la couleur de la solution.
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Dear
How prepared this solution composed :
150 mM NaCl, 20 mM TES, 35 mM glucose and 0.1% bovine serum albumin
Cordialy
Hello Nouria,
Thank you for your message.
For detailed guidance on preparing this solution, we recommend contacting a tutor specialized in chemistry or laboratory techniques on Superprof.
A tutor will be able to provide you with personalized help and ensure your preparation is accurate.
Feel free to browse the available tutors on our platform!
Les cours sont compréhensibles merci
Cette article est vraiment très bonne