Chapitres
La masse volumique est une mesure importante dans divers domaines scientifiques, tels que la physique, la chimie, la géologie, la métallurgie et l'ingénierie, car elle peut aider à déterminer les propriétés physiques d'une substance et son comportement sous différentes conditions de pression et de température, et déterminer des éléments tels que :
?Sa densité
?️ Sa compressibilité
? Sa flottabilité
?♀️ Un exemple courant d'application de la masse volumique est dans la construction de bâtiments. Les architectes et les ingénieurs doivent calculer la masse volumique des différents matériaux de construction tels que le béton, l'acier, le bois et les briques pour s'assurer qu'ils peuvent supporter la charge du bâtiment et résister aux forces extérieures telles que le vent et les séismes.
Découvrez comment calculer la masse volumique dans cet article.


Calculer une masse volumique : les définitions ??
La masse volumique d'un échantillon est le rapport de la masse m de cet échantillon à son volume v. (ρ est la masse volumique) 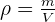
ou

ou
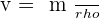
? La densité d'un liquide est égale au quotient de la masse d'un volume v par la masse d'un même volume d'eau. (la densité s'exprime sans unité) 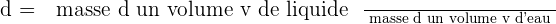
Qu'est-ce que le volume ?
Selon le domaine dans lequel ce mot est utilisé, la définition peut être différente. Mais, dans tous les cas, le volume représente une grandeur qui permet la mesure de l'extension d'un objet ou d'une partie de l'espace.
? En sciences physiques, le volume d'un objet permet de mesurer l'extension dans l'espace physique que celui-ci possède
♾️ En mathématiques, le volume d'une partie de l'espace géométrique correspond à sa mesure dans le sens de la théorie de la mesure de Lebesgue

Mesurer le volume d'un solide
Dans le Système International d'Unités, le volume se mesure :
- En mètre cube (m3) pour tous les objets,
- Le litre (L) est très fréquemment utilisé, notamment en ce qui concerne les liquides et autres matières sèches
De ce fait, on considère le volume comme étant une grandeur extensive dont la grandeur intensive thermodynamique associée est la pression.
La masse d'un corps
En physique, la masse correspond à une grandeur physique positive et intrinsèque d'un corps.
De façon plus précise, en physique newtonienne, la masse correspond à une grandeur extensive. Cela signifie alors que la masse d'un corps formé de parties correspond à la somme des masses de ces différentes parties qui le compose.
De plus, il est essentiel de noter que la masse est une grandeur conservative. De ce fait, elle reste constante dans le cas d'un système isolé qui n'échange donc pas de matière avec son environnement.
Pour une espèce donnée, la masse m, la quantité de matière n et la masse molaire M sont liés par :


Les propriétés de la masse
La masse peut se manifester au travers de deux propriétés fondamentales :
? La masse pesante en mécanique statique
? La masse inerte en mécanique dynamique
1️⃣ En mécanique statique, la masse est correspond à l'un des premières grandeurs facilement mesurables par les gens via le système de pesée puisque celle-ci permet de comparer la masse de l'objet défini avec une masse étalon connue. On appellera alors ce système "la masse pesante". C'est ainsi qu'on liera la quantité de matière d'un corps à sa masse.
2️⃣ En mécanique dynamique, la masse correspond à une grandeur qui intervient dans le principe fondamental de la dynamique comme étant la résistance de la matière au changement de vitesse. Plus la masse d'un corps est importante, plus il faudra exercer une force important pour modifier la direction ou encore sa vitesse. On appelle alors ce phénomène "masse inerte".
Ainsi, cet aspect de la masse présente un rôle essentiel dans tous les domaines de la dynamique puisqu'elle correspond à une notion présente dans grand nombre de relations de physique classique ou encore dans les calculs qui permettent de les définir.
En effet, il est possible de constater une proportionnalité entre la masse inerte et la masse pesante et cela de façon totalement indépendante de la nature du matériau mis en jeu. Cela permet alors de prendre la même unité pour la masse pesante et la masse inerte et donc de pouvoir les définir comme étant égales. Ainsi, cette équivalence a permis de définir un principe d'équivalence.
❌ Attention à ne pas confondre la masse et le poids !
L'unité de calcul
L'unité de masse est le kilogramme dans le Système international d'unités (S.I.).
Comme pour le litre il existe des sous-unités :
En kg
En hg
En dag
En g
En dg
En cg
En mg
Attention à ne pas faire comme une majorité et confondre la masse avec le poids. En effet, dans le vocabulaire de la physique :
✅ La masse est une grandeur physique positive intrinsèque d'un corps
❌ Le poids correspond à la force exercée par la gravité sur un corps pesant
La masse de l'objet dépend de la densité de l'objet mais également du volume.
?? Par exemple, un litre d'huile pèse 800 g et non pas 1 kg, alors qu'1 litre d'eau fera bien 1 kg.

Calculer une masse volumique : les bons procédés ?
La masse volumique d’une substance correspond à la masse de cette substance dans une unité de volume. S'il s’agit donc du rapport de la masse (m) de la substance par son volume (V, ici en m3 et non en L).
La masse volumique, notée ρ (lettre grecque qui se prononce rho), s’exprime selon la relation suivante :
ρ = m/Vm
- en kilogramme ( kg )
- V en mètre cube ( m3)
- ρ en kilogramme par mètre cube ( kg.m-3)
✅ Exemple. Nous avons une substance avec une masse m = 4kg et un volume de V = 500 dm3. Quelle est sa masse volumique ?
- Conversion du volume en m3
V = 500 dm3 = 0,5 m3
- Calcul de la masse volumique ρ
On sait que : ρ = m/V
Ainsi, ici, ρ = = 8 kg.m-3
Les unités de masse volumique
La masse volumique peut être exprimée selon d’autres unités que le kilogramme par décimètre cube (kg.m3). En effet, en payant une grande attention aux conversions, on peut utiliser d’autres unités tout en conservant la cohérence nécessaire.
On sait que :
1 kg = 1000 g et 1 m3 = 1000 dm3
Ainsi, on peut écrire :
1 kg / 1 m3 = 1000 g / 1000 dm3 = 1 g / 1 dm3
De cette façon, la valeur de la masse volumique reste la même ; seules les unités varient. On pourrait également montrer que cela reste vrai pour le milligramme par centimètre cube (mg.cm-3).
Calculer la masse (m) d’une substance à partir de sa masse volumique (ρ)
Si l’on modifie la relation précédente qui exprimait donc la masse volumique en fonction du volume et de la masse, on peut alors calculer la masse :
ρ = m/V ↔️ m = ρ x V
- m en kilogramme (kg)
- V en mètre cube (m3)
- ρ en kilogramme par mètre cube (kg.m-3)
✅ Exemple. Un récipient contient V = 200 mL d’éthanol dont la masse volumique de ρ = 789 kg.m-3 . Quelle est la masse de l’éthanol ?
- Conversion du volume en m3
V = 200 mL = 0,2 L
Or 1 L = 1 dm3 Donc V = 0,2 L = 0,2 dm3 = 0,0002 m3
- Calcul de la masse m
On sait que : m = ρ x V
Ainsi, ici, on peut écrire : m = 789 x 0,0002
m = 0,1578 kg
m = 157,8 g
Le récipient contient donc 157,8 g d’éthanol.
Calculer le volume d’une substance à partir de sa masse volumique
Pour calculer le volume d’une substance à partir de sa masse volumique, il suffit de reprendre la relation précédente et par un simple rapport de proportionnalité on obtient :
✅ Exemple. Un morceau d’aluminium a une masse de 972 g et une masse volumique de 2700 kg/m3. Quel est alors le volume du morceau d’aluminium ?
- On a donc m = 972 g et p = 2700 kg.m3
- La masse donnée doit être convertie en kg : m = 972 g = 0,972 kg
- On utilise la relation V = m/ρ
Ainsi, on peut écrire :
- V = 0,972/27000
- V = 3,6 x 10-4 m3
- V = 0,36 m3

?♂️ Le saviez-vous ?
Il également possible de mesurer la densité des gaz et solides !
Si dans le cas de solides, celle-ci se calcule de la même manière que pour les liquides (rapport de la densité du solide sur la densité d’un solide de référence) ; pour les gaz, le rapport se fait en référence à la masse volumique de l’air !
?? La valeur de la masse volumique de l’air correspond à la masse d’1 L d’air à 0°C sous une pression de 760 mmHg et est de 1,29 g.
Comprendre le rôle de la densité ?
La densité d’une substance se note d et correspond au rapport de la masse volumique de cette substance par la masse volumique de l’eau pure à une température de 4°C.

La densité peut donc être calculée en utilisant la relation suivante :
d(substance)= ρ(substance)/ρ(eau)
Les deux masses volumiques doivent être exprimées dans la même unité
La densité n’a donc pas d’unité (les deux unités s’annulant) !
On sait qu’un litre d’eau a une masse d’un kilogramme ρeau = 1 kg.dm-3. Ainsi, si les masses volumiques (de l’eau et et de la substance) sont exprimées en kilogramme par décimètre cube (kg.dm-3), alors la relation devient :
- d(substance) = ρ(substance)/1
- donc d(substance) = ρ(substance).
Autrement dit, la densité de la substance est alors égale à sa masse volumique dans ces conditions (à savoir une masse volumique exprimée en kg.dm-3).
C’est pour cette raison que les notions de densité et de masse volumique sont souvent sujets à des confusions. Elles restent très liées mais quelque peu différentes.
Densité et repérage des phases d’un mélange de liquides non miscibles
La densité est la grandeur qui permet de savoir si une substance flotte ou coule dans un autre liquide.
?? Par exemple, l’eau ayant une densité de 1 alors toute substance ayant une densité supérieure coule et pénétrer dans le liquide. En revanche, toute substance avec une densité inférieure flotte.
Plus généralement la substance ayant la plus faible densité flotte sur celle qui a la densité la plus élevée.
?? Par exemple la densité de l’essence est de 0,75 tandis que celle de l’éther est de 0,71. Donc l’essence coule et pénètre dans la solution d’éther.
En pratique : détermination expérimentale de la masse volumique d'un liquide ?

Matériel nécessaire
- Balance
- Fiole jaugée
Protocole pour le calcul de la masse volumique
- Faire la tare de la balance
- Placer la fiole jaugée sur la balance
- Relever la valeur qui s’affiche m1
- Remplir la fiole jaugée de volume V1 = 50 mL du liquide
- Peser alors l’ensemble fiole jaugée + 50 mL de liquide et noter la valeur de la masse m2
- Déterminer la masse volumique du liquide (en divisant la masse (m1) sur le volume (V1)
- Déterminer la densité du liquide (en divisant sa masse volumique par celle de l'eau)

Utilisations courantes du calcul de masse volumique ?
La masse volumique est une propriété physique importante dans divers domaines scientifiques, notamment :
? La géologie
? La métallurgie
? L'ingénierie
En géologie, la masse volumique des roches permet de déterminer la composition et la densité des roches, de caractériser les alliages et de prédire les propriétés des matériaux de construction en fonction de leur capacité à supporter une charge donnée.
L'industrie pétrolière et gazière utilise la masse volumique pour caractériser les fluides extraits du sous-sol, comme le pétrole brut ou le gaz naturel. Cela permet de déterminer leur quantité dans une zone donnée et de calculer la production maximale d'un puits.
En chimie, la masse volumique sert à caractériser les solvants et les réactifs, en laboratoire et en production à grande échelle. Elle est également utilisée dans l'industrie alimentaire pour évaluer les propriétés des produits alimentaires, comme les huiles ou les liquides de cuisson.
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Je vous remercie pour vos efforts
Une masse de 30cm à un ovaire
Équivaut a combien de livre si plein de liquide
merci
Merci !
Je suis très heureux de découvrir ce site…Merci
J’aime et j’apprécie votre travail
explication bin détaillée pour le rappel de ce cours
Bonjour, je vous encourage vivement à découvrir nos professeurs particuliers sur Superprof, qui sauront vous offrir un accompagnement sur mesure et détaillé, parfaitement aligné avec vos attentes personnelles. Passez une belle journée ! :)