Chapitres
- 01. La formule brute
- 02. La formule développée
- 03. La formule de Lewis
- 04. La formule semi-développée
- 05. Déterminer la géométrie d'une molécule
- 06. La représentation de Cram, une représentation 3D
- 07. Géométrie des molécules : la méthode VSEPR
- 08. Déterminer et représenter la polarisation d'une molécule
L'objectif du cours va être de voir en détail quelles sont les différentes méthodes existantes pour représenter les molécules dans le plan, et comment utiliser chaque méthode.

La formule brute
La formule brute est la représentation la plus simple d'une molécule, connue depuis le collège. Elle est dite "brute" car elle ne fournit que le minimum d'informations sur la molécule représentée :
- La nature chimique des atomes qui composent la molécule. Leur symbole atomique est alors utilisé (par exemple : O pour Oxygène, C pour Carbone, H pour Hydrogène etc.)
- Le nombre de chaque atome, qui est précisé en indice de chaque symbole atomique.
Remarque : lorsqu'il n'y a pas de nombre en indice d'un atome, cela sous-entend qu'un seul atome est présent. Ci-dessous quelques exemples de formules brutes :
- Eau : H2O, soit deux atomes d'Hydrogène et un atome d'Oxygène
- Ethane : C2H6 , soit deux atomes de Carbone et six atomes d'Hydrogène
- Acétone : C3H6O , soit trois atomes de Carbone, six atomes d'Hydrogène et un atome d'Oxygène
La formule développée
A partir de la formule brute de la molécule, il est possible d'aller plus loin dans le développement et d'écrire la formule développée de cette molécule. Celle-ci va alors donner des indications sur la répartition des atomes dans la molécule ainsi que sur les liaisons covalentes qui existent entre les différents atomes.
Symboliser les liaisons
Les liaisons simples sont des liaisons covalentes symbolisées par un tiret entre deux atomes. Il est également possible d'écrire des liaisons multiples entre des atomes. En particulier, les doubles liaisons (ou liaisons doubles) qui représentent l'établissement de deux liaisons entre deux atomes, sont symbolisées par deux tirets parallèles. Enfin, il existe également les triples liaisons (ou liaisons triples), qui sont elles, symbolisées par trois tirets parallèles, correspondant à l'établissement de trois liaisons entre deux atomes.
Liaisons établies par les principaux atomes
Dans un solide moléculaire les atomes sont liés par des liaisons covalentes : les deux atomes mettent en commun leurs électrons célibataires pour créer un doublet liant.
Quand les deux atomes sont identiques, la paire d’électron qui relie les deux atomes est répartie équitablement entre les deux atomes. On dit alors que la molécule est apolaire.
Quand deux atomes qui mettent leurs électrons en jeu sont différents et qu’il existe une différence d’électronégativité significative entre ces deux atomes, la liaison est dire polarisée et on appelle ce type de molécule, molécule polaire.
Une liaison covalente est dite polarisée si les deux atomes qui sont liés ont des électronégativités très différentes. En effet, dans ce cas, un des deux atomes aura tendance à attirer les électrons, ce qui a pour effet de polariser la liaison. Plus la différence d’électronégativité est grande et plus la polarisation de la liaison sera importante. Il se forme ainsi une sorte de dipôle électrique.
Le décalage des électrons conduit à noter une charge partielle négative δ– sur l’atome le plus électronégatif et une charge partielle positive δ+ sur le moins électronégatif
La stabilité des structures électroniques est aussi impactée par l'électronégativité.
L’électronégativité d'un élément est sa capacité à attirer les électrons lors de la création de liaisons chimiques avec d'autres éléments
On peut trouver l'électronégativité d'un élément grâce à sa position dans le tableau périodique des éléments.
En effet il existe un lien entre la période et l'électronégativité.
Par exemple, en lisant le tableau de gauche à droite, sur une période, l'électronégativité augmente. Il en va de même si on lit le tableau de bas en haut par colonne.
La classification périodique des éléments, aussi appelée tableau de Mendeleïev, du nom de son créateur. C’est un chimiste russe qui en 1869 créa un tableau dont le but était de regrouper tous les éléments chimiques connus par points communs (groupes et familles par exemple). Il a souvent été ajusté et mis à jour depuis cette époque.
Sa dernière révision date de 2016 par l’UICPA (Union internationale de chimie pure et appliquée), une ONG suisse qui a pour but l’évolution de la physique-chimie. Le tableau périodique compte à ce jour 118 éléments.
Afin d'écrire facilement les formules développées, il est important de connaître le nombre de liaisons covalentes que peuvent établir les principaux éléments chimiques de la classification périodique. En effet, chaque atome ne va pouvoir former qu'un nombre limité de liaisons covalentes, ce nombre étant défini grâce aux règles du duet et de l'octet. Le tableau ci-dessous récapitule le nombre de liaisons covalentes que peuvent former les principaux éléments chimiques, ainsi que la forme que peuvent prendre ces liaisons (simples, doubles ou triples) :
| Atome | Symbole chimique | Nombre liaisons covalentes | Liaisons covalentes possibles |
|---|---|---|---|
| Hydrogène | H | 1 | 1 liaison simple |
| Oxygène | O | 2 | 2 liaisons simples ou 1 liaison double |
| Azote | N | 3 | 3 liaisons simples ou 1 liaison simple et 1 liaison double ou 1 liaison triple |
| Carbone | C | 4 | 4 liaisons simples ou 2 liaisons simples et une liaison double ou 2 liaisons doubles ou 1 liaison simple et 1 liaison triple |
Les liaisons covalentes
Définition
Une liaison covalente entre deux atomes correspond à la mise en commun entre ces deux atomes de deux électrons de leurs couches externes pour former un doublet d'électrons appelé doublet liant. Le doublet liant, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des atomes liés.
Nombre de liaisons covalentes établies par un atome
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
Exemples de calcul du nombre de liaisons pour des atomes fréquemment rencontrés
| Atome | Couche externe électrons périphériques | Calcul n=8-p (ou n=2-p) p: nombre d'électrons périphériques | Nombre de liaisons |
|---|---|---|---|
| Hydrogène H (Z=1) | (K)1 | n=2-1 | n=1 |
| Carbone C (Z=6) | (K)2(L)4 | n=8-4 | n=4 |
| Azote N (Z=7) | (K)2(L)5 | n=8-5 | n=3 |
| Oxygène O (Z=8) | (K)2(L)6 | n=8-6 | n=2 |
| Chlore Cl (Z=17) | (K)2(L)8(M)7 | n=8-7 | n=1 |
La règle du duet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z < 4 évoluent de manière à saturer leur couche (K). Ils acquièrent un "duet" d'électrons c'est-à-dire une paire d'électrons.
La règle de l'octet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z > 4 évoluent de manière à saturer leur couche externe (L) ou (M) etc... Ils acquièrent un "octet" d'électrons c'est-à-dire 8 électrons ou 4 paires d'électrons. Il existe des exceptions à la règle de l'octet. Ces exceptions ne sont pas étudiées dans le cadre du cours de seconde.
Les doublets liants
Les doublets liants ont été définis précédemment comme les doublets mis en commun entre deux atomes. Ce sont eux qui assurent les liaisons entre les atomes.
Les doublets non liants
Les doublets non liants sont les paires d'électrons qui ne servent pas de liaisons entre deux atomes.
Les forces de Van Der Waals au sein d'une molécule
Nommées ainsi en l'honneur de Johannes Diderik van der Waals, un physicien néerlandais du XIX -ème siècle, ces forces peuvent se décrire comme les interactions électroniques entres les atomes ou molécules, qui les lient ensemble.
Johannes Diderik van der Waals fut le premier à les prendre en compte dans ses calculs en 1873. Cela lui valut de recevoir en 1910 le prix Nobel de physique.
Un prix Nobel, Nobelpriset de son nom original en suédois, est une récompense au niveau mondial qui gratifie son détenteur d’être l’une des personnes ayant apporté le plus grand bénéfice à l’humanité. C’est un prix qui se remet tous les ans. Le premier a été remis en 1901. Ils récompensent des découvertes ou un travail en faveur de la paix.
Il en existe 5 : le prix Nobel de physique, le prix Nobel de chimie, le prix Nobel de la paix, le prix Nobel de médecine et de physiologie et le prix Nobel de littérature.
Ce phénomène s'explique par la répartition des charges au sein d'une molécule ou au sein des couples d'atomes. Pour plus de détails, il faut néanmoins se plonger dans la physique quantique pour en comprendre les principes les plus poussés.
On peut leur trouver trois origines :
- L'interaction électrostatique attractive entre deux multipôles induits, il s'agira dans ce cas des forces de London ;
- L'interaction attractive entre un multipôle permanent et un multipôle induit et il s'agira des forces de Debye ;
- L'interaction électrostatique attractive ou répulsive entre deux multipôles permanents selon leurs orientations, il s'agit alors des forces de Keesom.
Les exemples les plus flagrants des effets des forces de Van Der Waals sont les absorptions par capillarité ainsi que les systèmes d'accroche des pattes de gecko qui peuvent coller aux murs.
Il existe plusieurs types de forces qui font que les molécules s'attirent les unes les autres. Vous en avez quelques exemples dans notre partie ci-dessus.
Règles pour l'écriture des formules développées
Pour écrire la formule développée d'une molécule, il faudra appliquer les règles suivantes :
- Représenter chaque atome par son symbole chimique, autant de fois qu'il apparaît dans la molécule
- Représenter les liaisons covalentes par des tirets
- Associer à chaque atome le bon nombre de liaisons covalentes
Quelques exemples de formules développées
Exemple de l'eau : H2O
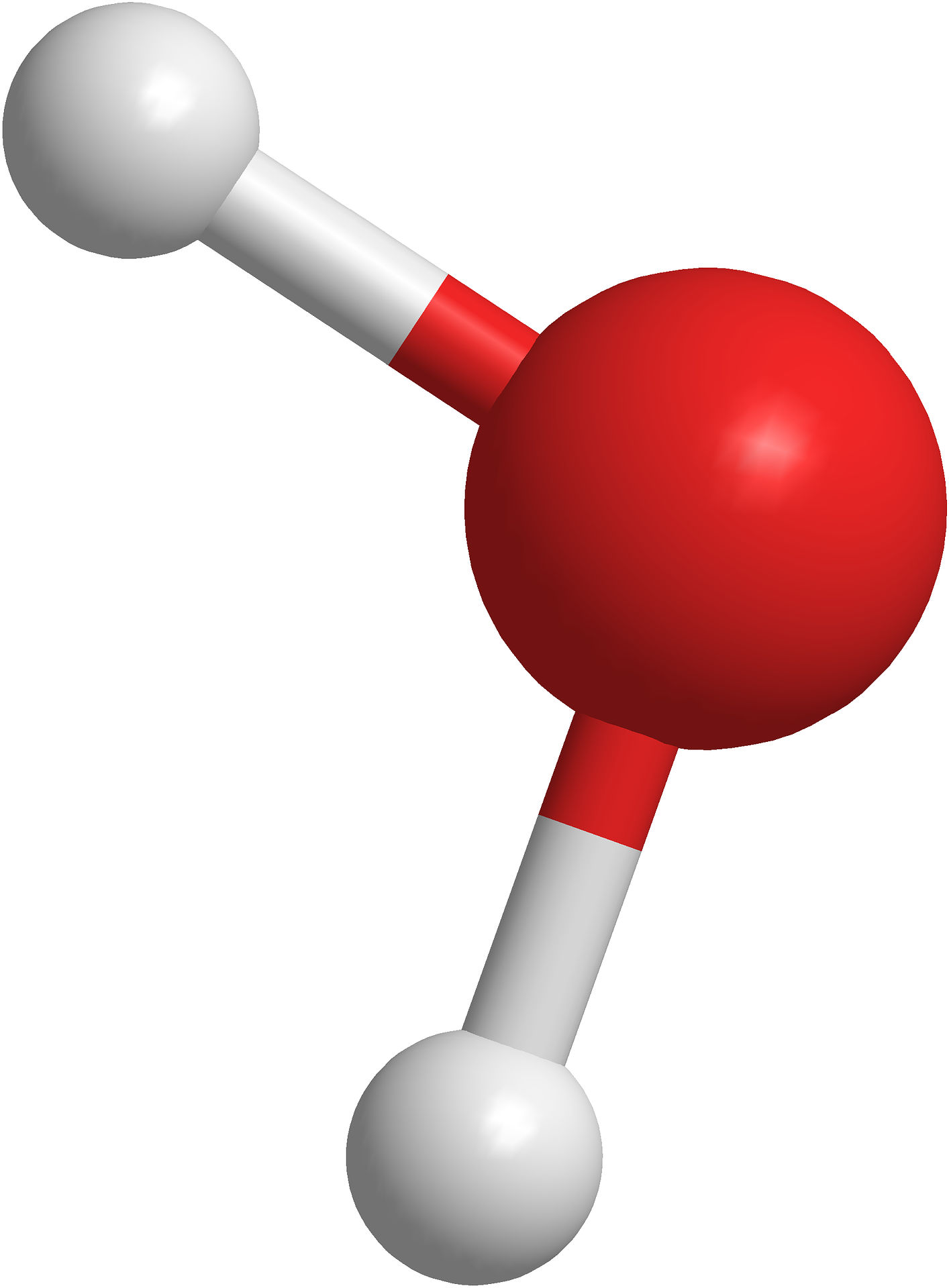
L'eau contient deux atomes d'Hydrogène qui peuvent former chacun une liaison, et un atome d'Oxygène qui peut former deux liaisons. La configuration la plus évidente est de mettre l'Oxygène au centre et un atome d'Hydrogène de chaque côté : 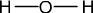
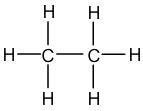
Exemple de l'éthane : C2H6

L'éthane contient deux atomes de Carbone, qui peuvent chacun former quatre liaisons, et six atomes d'Hydrogène, qui peuvent former chacun une liaison. L'objectif est de relier ensemble tous ces atomes. Compte-tenu de ces informations, il est préférable de commencer par placer les atomes de Carbone, qui vont créer le plus de liaisons. Les atomes de Carbone vont donc être liés ensemble, et les atomes d'Hydrogène vont venir se placer autour, respectant ainsi le bon nombre de liaisons covalentes pour les atome de Carbone et d'Hydrogène : 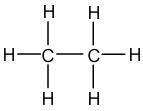
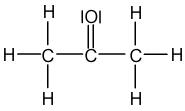
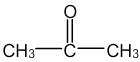
Exemple de l'Acétone : C3H6O

L'Acétone contient trois atomes de Carbone, qui peuvent chacun former quatre liaisons, six atomes d'Hydrogène, qui peuvent former chacun une liaison et un atome d'Oxygène, qui peut former deux liaisons. Les trois atomes de Carbone vont être liés ensemble, au centre de la molécule. 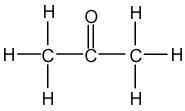
La formule de Lewis
La formule de Lewis est l'écriture d'une molécule sur laquelle on va faire apparaître l'ensemble des doublets d'électrons : les doublets qui forment les liaisons covalentes simples et multiples (= doublets liants) mais aussi les doublets qui ne participent pas aux liaisons covalentes (= doublets non liants). Par rapport à la formule développée, la formule de Lewis fait intervenir l'écriture des doublets non liants. Ainsi, pour écrire la formule de Lewis, il faut suivre les mêmes règles que pour l'écriture de la formule développée et y ajouter les doublets non liants. Reprenons les exemples précédents de l'eau, de l'éthane et de l'acétone :
| Eau | Ethane | Acétone |
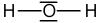 |  |  |
Inversement, en partant de la formule de Lewis, il sera possible de revenir à la formule développée en supprimant tous les doublets non liants de la représentation. La formule de Lewis est la représentation la plus riche, qui fournit le plus d'information sur la molécule représentée. Remarque : si les atomes d'une molécule ne comportent pas de doublets non liants alors la formule de Lewis et la formule développée sont identiques.
La formule semi-développée
Pour finir, la dernière représentation plane possible est la formule semi-développée. Cette forme de représentation d'une molécule est un intermédiaire entre la formule brute et la formule développée. Un peu plus compacte que la formule développée mais un peu plus détaillée que la formule brute, elle consiste à partir de la formule développée, et à masquer toutes les liaisons que les atomes d'Hydrogène font avec d'autres atomes. Quant aux autres liaisons, elles restent représentées. Ci-dessous se trouvent les exemples des formules semi-développées des molécules d'Eau, d'Ethane et d'Acétone.
- Sur la molécule d'eau, les liaisons entre l'Hydrogène et l'Oxygène ont été masquées
- Sur la molécule d'Ethane, la liaison covalente entre les deux atomes de Carbone reste apparente tandis que toutes les liaisons entre les atomes de Carbone et les atomes d'Hydrogène sont masquées
- Enfin, sur la molécule d'Acétone, les liaisons entre les atomes de Carbone ainsi que la double liaison entre l'atome de Carbone et l'atome d'Oxygène sont conservées, alors que les liaisons entre les atomes de Carbone et les atomes d'Hydrogène ont été masquées conformément à la règle d'écriture de la formule semi-développée.
| Eau | Ethane | Acétone |
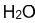 |  |  |
Déterminer la géométrie d'une molécule
Les représentations comme la formule brute, la formule développée ou la représentation de Lewis permettent de rendre compte de la composition d’une molécule, de l’enchaînement des atomes et de la présence des doublets non liants, mais elles ne fournissent pas d’informations sur la répartition spatiales des atomes dans une molécule.
En effet, dans la représentation de Lewis, on fait apparaître les doublets non liants.
Dans la représentation développée, ces doublets n'apparaissent plus. Enfin, dans la représentation semi-développée, les liaisons entre les hydrogènes et les carbones ne sont plus représentées. Pour bien visualiser la forme en trois dimensions d'une molécule, on utilise des règles simples.
La géométrie d’une molécule dépend de l’orientation des liaisons par rapport aux atomes . Les doublets liants et non liants sont donc responsables de la géométrie d’une molécule.
En effet, ces doublets sont constitués d’électrons chargés négativement qui ont tendance à se repousser, ainsi ils vont s'orienter pour s'éloigner au maximum.
A retenir : une molécule adopte la géométrie qui lui confère la plus grande stabilité en éloignant le plus possible, les uns des autres, les doublets liants et non liant.
La représentation de Cram, une représentation 3D
Avant d'étudier la géométrie des molécules, il faut utiliser des règles d'écriture bien précises. La représentation de Cram a été introduite par le chimiste Donald James Cram en 1953.
Pour indiquer la répartition spatiale des atomes dans une molécule on peut utiliser la représentation de Cram qui utilise les conventions suivantes :
- Le plan dans lequel on étudie la molécule est le même que le plan de la feuille sur laquelle on travaille,
- On utilise un trait plein pour représenter un atome situé dans le plan,
- On utilise un triangle ou un trait plein épais pour représenter un atome se trouvant en avant du plan,
- On utilise un trait en pointillé ou un triangle hachuré pour représenter un atome sur trouvant en arrière du plan.
La représentation de Cram permet de représenter les molécules et leurs liaisons. L'avantage de cette représentation est qu'elle permet de mettre en perspective la molécule étudiée.
Pour aller plus loin : il existe d'autres types de représentations comme la représentation de Fisher ou la représentation de Haworth qui sont utilisées pour étudier les molécules cycliques comme les glucides, ou la représentation de Newman qui est une projection.
Géométrie des molécules : la méthode VSEPR

La méthode VSEPR (Valence Shell Electron Pair Repulsion) a été inventée par le chimiste R.J Gillespie en 1957. Cette méthode permet de visualiser la forme d’une molécule dans l’espace.
Cette méthode est aussi appelée théorie de Gillespie.
Il s’agit d’une méthode de représentation des molécules basée sur la théorie de la répulsion des électrons de la couche de valence : les paires d’électrons liantes et libres se repoussent mutuellement.
Cette représentation permet de visualiser la représentation de Lewis dans l’espace et permet de compléter la représentation de CRAM.
La méthode VSEPR permet également de pouvoir étudier la réactivité des molécules et prévoir l'existence de moments dipolaires électrostatiques (comme les forces de Van Der Waals).
Les molécules peuvent être ainsi décrites grâce à ce système :
AXmEn
- A : représente l’atome central
- X : représente les paires d’électrons liantes
- E : représente les paires d’électrons libres
Les nombres m et n représentent respectivement les nombres de doublets liants et de doublets non liants.
- Molécules possédant deux doublets : AX2E
Cas des molécules AX2E : les molécules AX2E possèdent deux paires d’électrons liants. Les deux paires sont opposées au maximum et la molécule est linéaire (180°).
Un exemple de ce type de molécules est le dioxyde de carbone (CO2).
- Molécules possédant trois doublets : AX3, AX2E, AXE2
Cas des molécules AX3 : dans ce cas, les doublets électroniques se repoussent pour former un triangle équilatéral parfait dont les angles sont égaux à 120°.
La molécule SO2 est un exemple de molécule dont la configuration dans l’espace forme un triangle équilatéral.
- Molécules possédant quatre doublets : AX4, AX3E, AX2E2, AXE3
Cas des molécules AX4 : les molécules possédant quatre doublets ont une géométrie en forme de tétraèdre. Les angles formés par les molécules sont de 109°.
Les molécules possédant ce type de géométrie sont par exemple le méthane (CH4).
- Molécules possédant cinq doublets : AX5, AX4E, AX3E2, AX2E3, AXE4
Cas des molécules AX5 :quand les molécules possèdent 5 doubles, les atomes se placent dans une configuration de bipyramide trigonale. Ce type de molécules possèdent des angles de 90° et des angles de 120°.
La molécule PCl5 répond à ce type d’agencement spatial.
- Molécules possédant six doublets : AX6 AX5E, AX4E2, AX3E3, AX2E4, AXE5
Cas des molécules AX6 : les molécules avec six doublets possèdent une géométrie de bipyramide à base carrée (octaèdre) avec des angles de 90°. La molécule SF6 est une molécule présentant une géométrie octaédrique.
Voici un petit tableau récapitulatif :
| Description | Forme | Exemple de molécule |
|---|---|---|
| AX2 | Linéaire | CO2 |
| AX3 | triangulaire plane ou trigonale | BCl3 |
| AX4 | Tétraèdre | CH4 |
| AX5 | Bipyramide trigonale | PF5 |
| AX6 | Octaèdre | SF6 |
Note : l'existence des doublets non liants peut modifier les angles.
Labilité de la structure
Une fois que l'on est sûr que la molécule est la bonne, il peut être intéressant d'avoir recourt à une formule VSEPR, c'est à dire Valence Shell Electron Pair Repulsion, afin de décrire la structure de la molécule.
En effet, en prenant l'exemple d'une structure en bipyramide trigonales, on considère la molécule présente une structure labile. Cela signifie que, par une pseudo rotation de Berry, les deux atomes apicaux peuvent s'échanger avec deux atomes équatoriaux tandis que le troisième atome, qui reste donc inchangé, est appelé pivot de la pseudo rotation.
On peut alors, via la description VSEPR d'une molécule, décrire sa labilité.
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions qui concernent principalement la nature des liaisons entre atomes :
- Les atomes dans une molécule sont liés par des paires d'électrons ;
- Deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples ;
- Certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants ;
- Les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces ;
- Les doublets non liants occupent plus de place que les doublets liants ;
- Les liaisons multiples prennent plus de place que les liaisons simples.
Déterminer et représenter la polarisation d'une molécule

Électronégativité des atomes
Dans le domaine de la chimie, on décrit l'électronégativité comme étant une grandeur physique caractérisant la capacité d'un atome à attirer un ou plusieurs électrons lors de la formation d'une liaison chimique avec une autre espèce.
Selon leur configuration électronique, certains atomes capteront les électrons facilement alors que d'autres n'y arriveront pas. Par exemple, l'atome de fluor a pour configuration k2l7, il gagnera facilement un électron pour saturer la couche l.
La facilité des atomes à capter un électron s'appelle l'électronégativité. Dans le tableau périodique, les atomes les plus électronégatifs se trouvent en haut à droite.
Polarité d'une liaison chimique
Lorsque deux atomes sont liés chimiquement, c'est qu'ils mettent en commun deux électrons. Les deux électrons sont alors en orbite autour des deux noyaux, ils forment alors la liaison.
Dans le cas de deux atomes identiques, le doublet est également partagé et symétrique par rapport à l'axe de liaison.
Dans le cas où, les deux atomes sont différents, celui qui est le plus électronégatif attire plus fortement le doublet. Le nuage électronique est alors plus dense du côté de l'atome le plus électronégatif et crée une charge négative à cet endroit et positive sur l'autre atome. Une telle molécule possède deux pôles électriques, on dit qu'elle est polarisée.






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Ou acheter des formules développées pour représentation educative
Bonjour ! Contactez nos professeurs sur Superprof pour un soutien personnalisé qui vous aidera à atteindre vos objectifs. Bonne journée !
Merci .
Que se passe-t-il lorsque l’on passe de la formule linéaire d’une molécule à sa forme cyclique
Bonsoir,
Connaissez-vous la configuration moléculaire de l’éthane ( C2H6) ? s’il vous plait.
Merci beaucoup
Chui vrment faible en PC et j’ai besoin ďaide.
– S’il vous plaît, je veux une solution pour cet exercice, et merci beaucoup
– Soit un composé organique de formule brute C12H14O2. Son spectre RMN de proton montre un singulet à 2,3 ppm de 3protons, un singulet à 3,8 ppm de 2 protons et un doublet à 7,2 ppm de 2 protons.
1-reconstituer son spectre et interpréter le.
2-donner sa formule semi-développée.