Chapitres
- 01. Résumé sur le fonctionnement de l'atome ⚛️
- 02. Tout savoir sur les bases de l'atome ?
- 03. Les caractéristiques de l'atome ?
- 04. Comprendre les électrons ⚡️
- 05. Étude des couches électroniques des atomes et des ions ?
- 06. Étude de la structure électronique ?
- 07. Configuration de quelques atomes ?
?️ Les électrons, chargés négativement, orbitent autour du noyau atomique. Ils occupent des couches électroniques organisées en niveaux d'énergie croissants. La répartition des électrons dans ces couches influence les propriétés chimiques et les liaisons atomiques.
Apprenez tout sur les atomes dans cet article ! ?

Résumé sur le fonctionnement de l'atome ⚛️
? Les électrons et les couches électroniques sont des composantes fondamentales de la structure atomique. Les électrons, chargés négativement, orbitent autour du noyau d'un atome, constitué de protons et de neutrons. Chaque électron occupe une orbite, également appelée couche électronique, autour du noyau.
? Ces couches sont organisées en niveaux d'énergie successifs, numérotés de l'intérieur vers l'extérieur, de manière croissante. La première couche, la plus proche du noyau, peut contenir jusqu'à 2 électrons. La deuxième couche, 8 électrons, et ainsi de suite
? Le modèle atomique de Bohr a contribué à expliquer la répartition des électrons dans les couches, décrivant comment les électrons occupent d'abord la couche la plus proche avant de remplir les couches extérieures. Cependant, le modèle de Schrödinger, basé sur la mécanique quantique, est plus précis et décrit les probabilités de localisation des électrons dans des "orbitales" plutôt que sur des trajectoires définies.
?? La compréhension des électrons et des couches électroniques est cruciale en chimie, car elle détermine les propriétés chimiques et les liaisons entre les atomes, formant ainsi la base de la matière et de la chimie dans le monde qui nous entoure.
Tout savoir sur les bases de l'atome ?

Voici quelques basiques concernant la structure de l'atome :
- L’atome est composé d’un noyau, formé par des nucléons
- Les nucléons sont composés de protons et de neutrons
- Les électrons, quant à eux, gravitent autour du noyau
L’atome est constitué d’un certain nombre d’électrons, qui se trouvent donc autour du noyau, le noyau représentant pratiquement toute la masse de l’atome.
Il y a autant d’électrons que de protons au sein d’un atome.
? La découverte de l'atome fut l'une des plus grandes découvertes bouleversant notre monde scientifique. La connaissance de son existence a donc permis d'aboutir à une autre grande découverte : l'énergie nucléaire. Bien qu'elle révolutionnaire par ses principes de fonctionnement tels que la fission nucléaire, aujourd'hui les scientifiques se rendent de plus en plus comptes des dégâts et des traces qu'elle laisse sur notre monde.
☄️ De nouvelles formes d'énergie nucléaire sont en cours de recherches comme la fusion nucléaire mais il est encore trop incertain de pouvoir l'utiliser. Son utilisation serait encore une grande avancée car, contrairement à la fission, elle présente de nombreux autres avantages. Il n'y aurait quasiment plus de déchets radioactifs, et les risques d'accidents nucléaires dévastateurs seraient nuls.
⚡️La première approche des électrons date de l'époque de la Grèce Antique. Ceux-ci avaient pris conscience qu'une certaine oléorésine, l'ambre était capable d'attirée des objets si elle était frottée avec de la fourrure. Sans le savoir, ils venait de découvrir l'électricité statique. Il s'agit du deuxième phénomène électrique dont l'Homme a pris conscience, juste après la foudre. En 1269, un ingénieur militaire qui servait auprès du prince Charles Premier de Sicile, se mit à étudier le phénomène d'attirance ente des petits objets après qu'ils aient été frottés.
?? La découvert de l'atome est imputable à Ernest Rutherford. Durant le début des années 1910, il s'est attelé à comprendre la composition de l'atome. Il a alors déterminé que l'atome était constitué d'un noyau qui concentrait toute la charge positive et aussi presque toute la masse de l'atome. Ce noyau est entouré d'un nuage électronique composé d'électrons. L'un de ses collègues de laboratoire, Niels Bohr, a quant à lui démontré que les états de l'électrons dépendaient de l'énergie déterminée par le nombre n de l'atome. C'est à lui qu'on doit la compréhension de l'émission d'un photon lors d'un passage à un état inférieur.
Les caractéristiques de l'atome ?
Les atomes sont les unités de base de la matière. Ils se composent d'un noyau central, formé de protons (chargés positivement) et de neutrons (sans charge), entouré par des électrons (chargés négativement) en orbite dans des couches électroniques.
Les atomes diffèrent par leur nombre de protons, déterminant leur élément chimique, et par leur configuration électronique, influençant leurs propriétés chimiques.

Les isotopes
✍? On appelle atomes isotopes les ensembles d'atomes caractérisés par le même numéro atomique Z et des nombres de nucléons A différents. Ce sont donc des ensembles d'atomes qui ne diffèrent que par le nombre de leurs neutrons.
La taille d'un atome
? Elle est infiniment petite. Le diamètre d'un atome vaut en moyenne 10-1 nm ( 1nm = 10 -9 m ). Le diamètre du noyau vaut en moyenne 10-6 nm.
Le noyau est 100 000 fois plus petit que l'atome.
Entre les électrons et le noyau, il n'y a que du vide. On parle de la structure lacunaire de l'atome.
La masse d'un atome
La masse des électrons est négligeable devant celle du noyau. On dit que la masse d'un atome est concentrée dans son noyau.
La charge électrique d'un atome
⚡️ C'est la somme de la charge électrique + des particules du noyau et celle – des électrons. Cette somme est nulle : on dit que l'atome est électriquement neutre.
Les charges électriques étant les même, il y a autant d'électrons qui gravitent autour du noyau que de particules le constituant.
Exemple : L'atome de fer a 26 électrons et 26 particules + dans son noyau
Stabilité de l'atome
? Pour que le noyau et les électrons restent stables entre eux. Ils sont donc liés par une énergie de liaison. Si ils ne sont pas bien liés entre eux, les atomes deviennent instables et se transforment. Ils sont donc radioactifs. Il existe trois types de radioactivité.
Radioactivité gamma
La radioactivité gamma est un rayonnement provoqué par une désintégration gamma. Le plu souvent, ces désintégrations accompagnent des désintégrations alpha ou bêta. En effet, quand il émet un rayon alpha ou bêta, le noyau devient excité. Lors de l’émission d’un rayonnement électromagnétique gamma, le noyau peut donc redescendre à un état plus stable.
Radioactivité bêta
La radioactivité bêta est un type de désintégration radioactive où une particule bêta (électron ou positron) est émise. On parle de radioactivité bêta + quand un positron est émis mais on parle de radioactivité – quand c’est un électron qui est émis.
Radioactivité alpha
La radioactivité alpha est un rayonnement provoqué par une désintégration alpha qui est une désintégration radioactive où un noyau atomique éjecte une particule alpha qui se transforme en un autre noyau dont le nombre de masse est diminué de 4 et le numéro atomique de 2 à cause de la particule alpha manquante qui est analogue au noyau d’hélium 4.
Comprendre les électrons ⚡️
Un électron est une particule subatomique présente dans les atomes, portant une charge négative. Il orbite autour du noyau atomique, composé de protons et de neutrons, et détermine les propriétés chimiques de l'élément.
Les électrons participent aux liaisons chimiques et sont essentiels dans la formation de molécules et de matière.

Les électrons sont des particules plusieurs milliers de fois plus petites que les nucléons, portant une charge élémentaire négative (-e = -1,6×10-19 coulomb) et de masse me= 9,1 x 10-31 kg (environ mille fois plus léger qu’un nucléon).
Les électrons font partie des composants des atomes et des ions.
Nombre d'électrons dans un atome
⚛️ Un atome est toujours électriquement neutre ce qui signifie que les charges positives sont compensées par les charges négatives. Or un électron porte une charge qui est exactement l’opposée de celle d’un proton donc il y a autant d’électrons que de protons.
Le numéro atomique (Z) d’un élément chimique indique donc à la fois le nombre de protons et le nombre d’électrons.
Exemple : l’atome de phosphore à comme numéro atomique Z = 15 donc son noyau comporte 15 protons et comme il est neutre il possède aussi 15 électrons.
État des électrons
? L’état énergétique d’un électron ne peut pas varier continuellement mais seulement par sauts discontinus entre des états stables définis. Les électrons sont ainsi répartis par « couches » appelées couches électroniques que l’on représente souvent comme des couches concentriques et qui se nomment K, L, M.
Un peu d’histoire…
? L’atome d’hydrogène a été un modèle d’étude important car il s’agit de l’atome le plus simple. L’atome d’hydrogène peut absorber ou émettre des quantités d’énergie bien définies : cela correspond au passage de l’atome d’un niveau d’énergie à un autre. Le saut d’énergie se manifeste alors par une raie d’émission dans le spectre de l’atome.
?? C’est le scientifique Balmer qui découvrit ces transitions dans le visible, en premier. Puis Paschen découvrit des transitions dans l’infrarouge et Lyman dans l’ultraviolet. Cependant, ces scientifiques se doutaient bien qu’il pouvait exister d’autres transitions plus loin vers l’infrarouge ou vers l’ultraviolet. Ainsi les termes K, L, M furent donnés pour ne pas commencer au début de l’alphabet et avoir une marge de noms dans les deux sens !
Étude des couches électroniques des atomes et des ions ?

Le modèle de Niels Bohr
?? Niels Henrik David Bohr est né le 7 Octobre 1885 à Copenhague et est mort le 18 novembre 1962 dans la même ville. Ce physicien danois est surtout connu pour sa contribution à l’établissement de la physique quantique. Il a d’ailleurs reçu pour cela de nombreux honneurs :
- Il a été lauréat du prix Nobel de physique en 1922 pour son développement des mécanique quantique
- En 1921, lauréat de la médaille Hughes
- En 1926, il devient membre étranger de la Royal Society
- Par la suite, il devient lauréat de la médaille Franklin, toujours en 1926
- Puis lauréat de la médaille de Copley en 1938
- N’étant ni membre d’une famille royale, ni chef d’Etat, il deviendra en 1947 le troisième et dernier Danois à être admis au sein de l’Ordre de L’Élephant au cours du xxe siècle
- Président de l’Académie royale danoise des sciences et des lettres de 1939 à 1962
L’ordre de l’Éléphant est un ordre de chevalerie danois. La décoration représente un éléphant portant une tour. C’est un insigne en émail blanc qui est suspendu à un collier d’or ou à un ruban bleu passé de l’épaule gauche au côté droit.
La Royal Society of London for the Improvement of Natural Knowledge, abrégée en Royal Society, est l’institution des sciences en Angleterre. Fondée en 1660 à Londres, elle est au Royaume-Uni l’équivalent de l’Académie des sciences en France.
? Il publia en 1913 un modèle atomique qui mettait en évidence le noyau central autour duquel gravitaient les électrons. Ces électrons avaient la possibilité de passer d’une couche à l’autre. Les électrons occupent des orbites bien définies, et le modèle de Bohr possède plusieurs caractéristiques :
- Les couches électroniques sont situées à des distances bien définies du noyau et ont des capacités d’accueil électronique également finies.
- La représentation en sous-couches K, L, M est pratique pour exploiter le modèle de Lewis, néanmoins, le modèle le plus intéressant et le plus précis reste celui des orbitales atomiques (ou probabilité de présence d’électrons dans un nuage électronique)
- Cette méthode qui exploite la mécanique quantique fait appel à des nombres appelés nombres quantiques n, l, m, s qui permettent de décrire les nuages électroniques.
Les couches électroniques
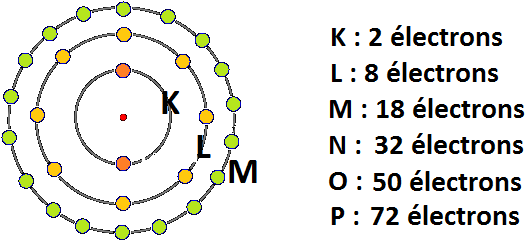
On sait donc que les électrons qui tournent autour du noyau d’un atome ou d’un ion ne se répartissent pas de manière aléatoire mais occupent des couches d’énergies différentes. Dans l’ordre croissant d’énergie et d’éloignement aux noyaux ces couches sont notées K, L M. La couche K peut contenir 2 électrons tandis que les couches L et M peuvent en recevoir 8.
? Les électrons commencent d’abord par remplir les premières couches avant d’occuper les suivantes.
- La couche K est donc la première couche à être remplie. C’est elle qui se trouve le plus près du noyau. C’est une couche ou les électrons ont tendance à être dans un état très stable.
- La couche L peut accueillir 8 électrons. C’est une couche un peu moins stable que la couche K.
- La couche M peut aussi accueillir 8 électrons et est encore un peu moins stable que la couche précédente
Notion de couche externe
? La couche électronique externe est la dernière couche de l’atome contenant des électrons. L’étude de cette couche est très importante car c’est elle qui donne le nombre de liaisons covalente qu’un atome peut réaliser et elle permet également d’avoir des informations sur la réactivité.
Étude de la structure électronique ?

Elle permet de décrire la répartition des électrons dans les différentes couches d’un atome ou d’un ion. Les couches comportant des électrons sont désignées par leur lettre, notées entre parenthèses et accompagnée en exposant du nombre d’électrons qu’elles comportent.
Exemple :
- La structure électronique de l’atome de magnésium est ( K )2( L )8( M )2
- Cela signifie que l’atome a 2 électrons dans sa première couche K, 8 électrons sur la couche suivante L et 2 électrons sur la couche M qui n’est donc pas complète
Comment écrire la structure électronique d'un atome ?
✍? Il faut dans un premier temps connaître le nombre total d’électrons que possède cet atome ce qui est indiqué par son numéro atomique Z.
Ensuite, il suffit d’écrire la première couche et d’y placer les 2 premiers électrons. S’il reste des électrons ils sont ensuite placés sur la couche L. Si la couche L est complète alors les électrons restant sont notés sur la couche M.
Exemple de l’atome d’aluminium
?? L’atome d’aluminium a comme numéro atomique Z = 13 ce qui signifie qu’il possède un total de 13 électrons. Les deux premiers électrons viennent compléter la première couche que l’on note ( K )2.
Il reste ensuite 13 – 2 = 11 électrons : les 8 électrons suivants viennent compléter la couche L ce qui donne ( K )2( L )8. Il reste 13 – 2 – 8 = 3 électrons qui appartiennent donc à la couche M.
? La configuration électronique de l’atome d’aluminium est donc ( K )2( L )8( M )3
Configuration de quelques atomes ?

La configuration d'un atome se réfère à la manière dont ses électrons sont répartis dans ses couches électroniques.
Cette répartition détermine les propriétés chimiques de l'élément et sa capacité à former des liaisons avec d'autres atomes, influençant ainsi la chimie, la réactivité et le comportement de la matière dans des réactions chimiques.
Cas du néon (Z = 10)
? Les deux premiers électrons viennent compléter la couche L : K2 Ensuite, il reste : 10-2 = 8 électrons à répartir. Ces 8 électrons complètent entièrement la couche suivante, L.
On a donc la configuration suivante : K2L8
On peut remarquer que le néon, qui est un gaz noble, possède ses deux couches électroniques saturées : il ne peut plus gagner ou perdre d’électron, il est stable.
Cas du carbone (Z =6)
?️ Les deux premiers électrons vont se placer sur la couche L puis les 4 suivants (puisque 6-2 = 4) vont se placer sur la couche M. On a donc comme configuration : K2L4 Le carbone possède 4 électrons sur sa couche externe.
Cas d’un ion, l’ion sodium Na+ (sodium Z = 11)
Pour le sodium, sous sa forme ionisée Na+, il a perdu un électron, son numéro atomique est donc de 11-1 = 10. Les deux premiers électrons remplissent la première couche électronique L puis les 8 autres électrons remplissent la couche M comme pour le Néon : K2L8 Le sodium Na+ a donc obtenu la configuration électronique que le gaz rare le plus proche.
Cas du magnésium (Z = 12)
Les deux premiers électrons se placent sur la couche K. Il reste encore (12-2 = 10) 10 électrons à placer. 8 électrons viennent saturer la couche L. Il reste alors (10-8 = 2) 2 électrons qui vont se placer sur la couche la plus externe, la couche M.
La configuration de l'atome de magnésium est donc la suivante : K2L8M2
Note : le magnésium peut être ionisé deux fois en Mg2+, cela signifie que le magnésium peut perdre 2 électrons de sa couche externe M pour obtenir une configuration plus stable, celle du gaz rare le plus proche, c'est à dire le néon de configuration K2L8.
Cas du soufre (Z = 16)
☄️ Les deux premiers électrons vont remplir la couche L. Les 8 électrons suivants vont ensuite remplir la couche M. Il reste 16-(2+8) = 6 électrons. Les 6 électrons restants vont remplir la couche M qui est la couche la plus externe La configuration de l’atome de soufre est donc K2L8M6.
Les résultats sont compilés dans le tableau suivant :
| Element | Configuration |
|---|---|
| Carbone (Z = 6) | K(2)L(4) |
| Néon (Z = 10) | K(2)L(8) |
| Sodium (Z = 11) | K(2)L(8)M(1) |
| Magnésium (Z = 12) | K(2)L(8)M(2) |
| Soufre (Z = 16) | K(2)L(8)M(6) |
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Je veux savoir beaucoup de choses sur physique chimie
J’aime bien votre document , j’aimerais avoir plus d’informations sur l’histoire d’atome et la méthodologie scientifique
Bonjour ! Pour un accompagnement personnalisé, je vous invite à découvrir nos professeurs dédiés sur Superprof. Ils sont à votre disposition pour vous aider à atteindre vos objectifs en fonction de vos besoins spécifiques. Belle journée à vous !
j’aime bien la physique chimique
Vraiment ,votre page est incroyable
Très bon site pour m’aider dans mes devoirs
Je demande des exercices d’application
Bonjour, envisagez de vous appuyer sur nos professeurs chez Superprof pour un accompagnement qui répond spécifiquement à vos besoins. Passez une agréable journée ! :)