Chapitres
- 01. Variations de la durée d'une réaction chimique
- 02. Les catalyseurs
- 03. Autres facteurs cinétiques
- 04. Développons ensemble
- 05. Qu’est-ce qu’une transformation chimique ?
- 06. L’avancement d’une réaction
- 07. Applications pratiques de la cinétique chimique
- 08. Études expérimentales : exemples
- 09. Ce qu'il faut retenir

Variations de la durée d'une réaction chimique
Par définition, chaque réaction chimique a sa propre durée de réaction. Cependant, il existe aussi de nombreux facteurs susceptibles de modifier ces durées de réaction. Il est ainsi possible de ralentir ou d'accélérer une réaction chimique en modifiant la concentration des réactifs, la nature du solvant, la pression ou encore la température du milieu, etc. Ces facteurs capables d'influencer le déroulement d'une réaction chimique sont appelés les facteurs cinétiques.
Les catalyseurs
Influence de la concentration
Le déclenchement d'une transformation chimique nécessite que les réactifs présents dans le milieu entrent en contact les uns avec les autres. Or, lorsqu'ils sont introduits, ils sont initialement dispersés dans le solvant et animés de mouvements aléatoires. Ainsi, la rencontre entre deux réactifs sera d'autant plus fréquente que les quantités des réactifs présents dans le milieu seront élevées.
Par conséquent : plus la concentration des réactifs est élevée, plus la vitesse de réaction est élevée.
En augmentant la concentration des réactifs, la formation des produits est donc plus rapide. Cependant, la durée de la réaction est dans ce cas plus longue car la quantité de matière qui doit être consommée est plus importante.
une des applications possibles consiste à réaliser une dilution du milieu réactionnel afin de stopper la réaction et analyser le mélange en cours de réaction.
Influence de la température
Une température plus élevée accroît l’agitation des particules et leur énergie cinétique, augmentant ainsi la probabilité de réaction :
- Les collisions sont plus fréquentes
- L’énergie permet de franchir l’énergie d’activation
Application pratique : chauffage à reflux en chimie ou autocuiseur pour accélérer la cuisson des aliments.
À l’inverse, une baisse de température ralentit la réaction, comme dans les réfrigérateurs ou congélateurs.
La température d'une substance reflète son état d'agitation thermique. Lorsque la température d'un milieu réactionnel augmente, les particules (molécules ou ions) sont donc plus agitées, et elles se déplacent plus rapidement. Cela va avoir deux conséquences :
- Les rencontres entre les différents réactifs sont plus fréquentes
- Les réactifs disposent d'une énergie cinétique plus grande et cette énergie permet d'augmenter la probabilité qu'une collision entre les réactifs conduise effectivement à une réaction chimique.
Par conséquent : l'augmentation de la température permet donc d'accélérer les réactions chimiques et de réduire leur durée. Elle permet également tout simplement parfois de déclencher des réactions chimiques.

Dans la pratique, l'augmentation de la température du milieu réactionnel est souvent réalisée en utilisant un chauffage à reflux : les réactifs sont alors introduits dans un ballon chauffé et surmonté d'une colonne à reflux, parcourue d'un courant d'eau froide qui va liquéfier les vapeurs issues du ballon et ainsi permettre d'éviter la perte de réactifs. Par ailleurs, un exemple très parlant dans la vie de tous les jours est l'utilisation d'un autocuiseur pour accélérer la cuisson des aliments, car la température y est très élevée. Inversement, la diminution de la température provoque un ralentissement de la réaction chimique, ce qui allonge alors la durée de la réaction. La technique du refroidissement est notamment mise à profit dans les réfrigérateurs (environ 4°C) et les congélateurs (environ -18°C) pour la conservation des aliments. En effet, non seulement ils permettent de ralentir voire bloquer l'activité bactérienne mais ils permettent également de ralentir les réactions chimiques de dégradation des produits alimentaires au contact de l'air (que ce soit le goût, l'aspect...).

Enfin, une autre application possible de la diminution de la température du milieu réactionnel consiste à refroidir brutalement un mélange en réaction, avec de la glace par exemple. L'objectif est alors de bloquer l'évolution de la réaction à un stade choisi et ensuite pouvoir analyser le mélange réactionnel. Cette technique est appelée la trempe.
Influence du solvant
Le solvant influence la réaction :
- Indirectement : par la dissolution, affecte la concentration des réactifs
- Directement : par des interactions chimiques comme les liaisons hydrogène ou Van der Waals, qui favorisent ou empêchent les collisions
Le solvant choisi pour dissoudre des réactifs n'est pas censé participer à la réaction chimique. Cependant, il est susceptible de dissoudre des quantités variables de solutés dont la concentration est un facteur cinétique important. En effet, plus la dissolution est importante, plus la concentration du soluté dans la solution est élevée. Et, comme expliqué un peu plus haut dans le point sur l'influence de la concentration, plus la concentration du soluté (= réactif) est élevée, plus la vitesse de réaction est élevée. Un bon solvant est un solvant qui dissoudra au mieux les solutés. Indirectement, le solvant a donc une influence sur la vitesse d'une réaction chimique. Par ailleurs, un solvant peut aussi avoir une influence directe sur la vitesse de la réaction. En effet, il peut interagir avec les réactifs, principalement par le biais de sa polarisation, des interactions de Van der Waals et des liaisons hydrogène. Ainsi, le solvant peut favoriser le contact entre les différents réactifs en présence dans le milieu réactionnel, ce qui va accélérer la réaction chimique. A l'inverse, le solvant peut aussi empêcher le contact entre les différents réactifs en présence dans le milieu réactionnel, ce qui va alors ralentir la réaction chimique.
Autres facteurs cinétiques
La concentration des réactifs
Plus les réactifs sont concentrés, plus les collisions entre molécules sont fréquentes, augmentant la vitesse de réaction.
La dilution peut stopper une réaction à un stade donné pour l’analyser.
Le catalyseur
Un catalyseur accélère une réaction chimique sans modifier les produits. Il participe temporairement à la réaction mais est régénéré à la fin.
Il ne peut accélérer que la réaction, pas la ralentir.
Exemples : zéolithes dans l’industrie, pots catalytiques dans les voitures, enzymes biologiques comme l’uréase.
L’agitation et la pression
- Agitation : barreau aimanté ou agitateur augmente les chances de collision entre réactifs
- Pression : en phase gazeuse, augmente la fréquence des collisions, accélérant la réaction
Développons ensemble
Au delà de la température, de la concentration des réactifs ou du choix du solvant, il existe beaucoup d'autres facteurs susceptibles d'avoir de l'influence sur la vitesse d'une réaction chimique.

Parmi tous ces autres facteurs cinétiques existants, peuvent être cités :
- L'ajout au milieu réactionnel d'une espèce chimique appelée "catalyseur". Le catalyseur est tout simplement une espèce chimique capable d'accélérer la vitesse d'une réaction chimique. Il est ajouté en très petite quantité au milieu réactionnel, et a la particularité de participer aux différentes étapes d'une réaction chimique, puis d'être régénéré à la fin de la réaction chimique.
le catalyseur n'influence la vitesse de réaction chimique que dans un sens. En effet, il ne peut pas être utilisé pour ralentir des réactions chimiques.
- La mise en agitation du milieu réactionnel. Elle est en général réalisée à l'aide d'un barreau aimanté et un agitateur magnétique. L'agitation permet d'augmenter la probabilité de mise en contact des différents réactifs présents dans le milieu réactionnel et donc d'accélérer la réaction chimique.
- L'augmentation de la pression lorsque la réaction chimique se déroule en phase gazeuse. Elle agit tout simplement de la même manière que la température : en phase gazeuse, plus la pression augmente, plus la vitesse de la réaction chimique augmente.
Qu’est-ce qu’une transformation chimique ?
Une transformation chimique correspond à la conversion d’espèces chimiques appelées réactifs en d’autres espèces appelées produits, par réarrangement des éléments chimiques. Lors de ce processus, certaines liaisons chimiques se coupent, libérant des éléments ou groupes d’éléments qui se recombinent pour former de nouvelles liaisons, créant ainsi de nouvelles substances chimiques.
Un changement d’état (fusion, vaporisation…) n’est pas une transformation chimique mais une transformation physique.
En effet, voici les principales différences entre une transformation physique et une transformation chimique.
| Critère | Transformation physique | Transformation chimique |
|---|---|---|
| Nature du changement | Modifie seulement l'état ou la forme de la matière | Produit de nouvelles substances |
| Composition chimique | Inchangée | Modifiée |
| Exemples typiques | Fonte de la glace, évaporation de l'eau | Combustion du bois, oxydation du fer |
| Réversibilité | Souvent réversible | Le plus souvent irréversible |
| Indices visibles | Changement d'état, de forme | Changement de couleur, dégagement de gaz, production de chaleur |
L’énergie au cœur de la réaction
Lors d’une réaction, l’énergie joue un rôle central. La formation de nouvelles liaisons consomme et libère de l’énergie, appelée énergie de liaison. La réaction ne peut se produire que si l’énergie disponible permet de franchir la barrière énergétique appelée énergie d’activation. La mesure de l’énergie dans le système s’effectue grâce à la fonction thermodynamique appelée enthalpie (H).
Les réactions échangent également de l’énergie avec leur environnement sous forme de chaleur (Q), dont la valeur dépend des conditions expérimentales :
Isobare (pression constante) : 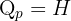
Isochore (volume constant) : 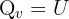
L’avancement d’une réaction
Pour une réaction chimique du type : 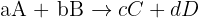
- x : avancement de la réaction
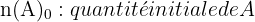
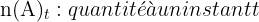
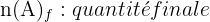
En solution aqueuse de volume constant V, la concentration molaire est : 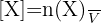
Et on peut relier l’avancement x aux concentrations : 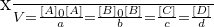
Temps de demi-réaction
Le temps de demi-réaction correspond au moment où l’avancement x atteint la moitié de l’avancement maximal 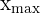 (dépendant du réactif limitant). Cette notion est particulièrement utile pour comparer la rapidité de différentes réactions ou l’effet d’un catalyseur.
(dépendant du réactif limitant). Cette notion est particulièrement utile pour comparer la rapidité de différentes réactions ou l’effet d’un catalyseur.
Applications pratiques de la cinétique chimique
Industrie chimique
Connaître la vitesse de réaction permet de maîtriser les procédés industriels, d’optimiser la production et de réduire les risques d’accidents chimiques.
Pharmacie
La cinétique des réactions des médicaments permet d’anticiper leur action et leur dégradation dans le corps.
Moteurs à combustion
La combustion optimale dépend de la compréhension des réactions chimiques rapides dans le moteur, que ce soit à essence ou diesel.
Écotoxicité et environnement
Surveiller la vitesse de réaction des substances chimiques permet de prévenir les impacts environnementaux lors de fuites ou de rejets.
Construction et bricolage
Matériaux comme le ciment, la brique ou le bois subissent des réactions chimiques dans le temps. Comprendre leur cinétique permet d’augmenter leur durabilité et d’éviter la fragilisation.
Études expérimentales : exemples
L’uréase
L’uréase est une enzyme qui catalyse la décomposition de l’urée en ammoniac et dioxyde de carbone.
- Sans enzyme : demi-réaction ~60 ans
- Avec enzyme : demi-réaction ~2×10⁻⁵ s
Conclusion : l’uréase est un catalyseur, accélérant drastiquement la réaction.
Saponification de l’éthanoate d’éthyle
La réaction de l’éthanoate d’éthyle avec une solution de soude permet d’étudier l’avancement de la réaction et sa cinétique via la conductimétrie. L’évolution de la conductivité permet de calculer l’avancement x(t)x(t)x(t) et la vitesse de réaction.
Ce qu'il faut retenir
La vitesse des transformations chimiques dépend d’un ensemble complexe de facteurs cinétiques : concentration, température, solvant, agitation, pression et catalyseurs. La compréhension de ces éléments est essentielle pour :
- Optimiser les réactions chimiques industrielles et pharmaceutiques
- Assurer la sécurité et l’efficacité dans les moteurs et les centrales nucléaires
- Préserver les matériaux et contrôler l’impact environnemental
En résumé, une transformation chimique n’est pas toujours rapide, mais sa durée peut être maîtrisée et optimisée grâce à la cinétique chimique et aux facteurs influençant la réaction.
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Vos cours sont simples et explicites très bonne continuation.
Merci
Comment agit la concentration des reactifs sur le temps de demi reaction
La vitesse d’une réaction chimique est elle la même dans le système et dans un prelevement de ce système؟
les methodes pour diminuer la concentration
Bonjour,
L’une des méthodes les plus simples pour diminuer une concentration est de la diluer. Pour cela, utilisez de l’eau déminéralisée que vous ajoutez à votre préparation. Attention toutefois aux doses pour ne pas trop la diluer !
Effectuez des mesures régulières ou calculez avec précision la quantité d’eau déminéralisée nécessaire à votre dilution.
Bonne journée
Est-ce que la dilution a un influence sur la réaction chimique,c’est-à dire est-ce qu’elle est capable de ralentir ou d’accélérer la réactio:
Mais qu’est ce qui influe le plus sur la vitesse, la temperature ou la concentration?
Bonjour, de mon point de vue je pense que c’est la température qui influe le plus sur l’accélération de la réaction car en diminution la concentration on aura toujours des chocs entre les particules si on augmente la température. La température apporte de l’énergie cinétique et la concentration non
Bonjour,
Tout dépend des conditions de l’expérience. Dans certains cas ce sera la température qui augmentera la vitesse de réaction et dans d’autres, ce sera la concentration.