Chapitres
La chimie organique nous permet de comprendre comment les molécules interagissent et se transforment. Parmi ces transformations, l’estérification est l’une des plus importantes. Elle illustre la notion d’équilibre chimique et met en jeu des alcools et des acides carboxyliques pour former des esters et de l’eau.
Ce phénomène, étudié en laboratoire mais aussi présent dans le vivant, permet d’aborder plusieurs notions fondamentales : la structure des molécules, les forces intermoléculaires, la catalyse, la polarité ou encore le pH.

Les esters : définition, structure et propriétés
Les esters sont des composés organiques dérivés de la réaction entre un acide carboxylique (–COOH) et un alcool (–OH). Leur groupe caractéristique est la fonction –COO–, et leur formule générale est R–COO–R’, où R et R’ désignent des chaînes carbonées.

Il ne faut jamais hésiter à compléter ses connaissances avec des livres.
Nomenclature
Le nom d’un ester se compose en deux parties :
- La première vient du radical de l’alcool (R’) avec la terminaison –yle ;
- La seconde vient de l’acide carboxylique, avec la terminaison –oate.
Exemple :
CH₃–COO–CH₂CH₃ → éthanoate d’éthyle.
Propriétés et utilisations
Les esters sont souvent liquides volatils, peu solubles dans l’eau mais miscibles dans les solvants organiques.
Leur odeur fruitée est caractéristique :
- L’éthanoate d’isoamyle évoque la banane,
- Le formiate d’éthyle rappelle la poire,
- Le butanoate d’éthyle sent l’ananas.
Ces propriétés olfactives expliquent leur emploi dans la parfumerie, les arômes alimentaires, et certains solvants industriels.
R–COO–R’, avec R = hydrogène ou chaîne carbonée, R’ = chaîne carbonée.
L’estérification : réaction entre un acide et un alcool
L’estérification est une réaction lente et réversible :
Acide carboxylique + Alcool ⇌ Ester + Eau
Par exemple :
CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅ + H₂O
(acide éthanoïque + éthanol → éthanoate d’éthyle + eau)
Mécanisme simplifié
- L’acide carboxylique est protoné par un catalyseur acide, rendant le carbone du groupe carbonyle plus électrophile.
- L’oxygène de l’alcool attaque ce carbone.
- Il se forme un intermédiaire tétraédrique instable.
- Une molécule d’eau est éliminée, laissant place à la fonction ester.
Cette réaction est souvent catalysée par l’acide sulfurique (H₂SO₄), qui joue aussi un rôle de déshydratant, accélérant la réaction.
Facteurs influençant la réaction
Plusieurs paramètres modifient la vitesse ou la position de l’équilibre :
- Température : plus elle augmente, plus la réaction est rapide ;
- Catalyseur : les ions oxonium (H₃O⁺) augmentent la vitesse sans modifier l’équilibre ;
- Rapport stœchiométrique : un excès d’un des réactifs (souvent l’alcool) déplace l’équilibre vers l’ester ;
- Élimination de l’eau produite favorise également la formation d’ester (principe de Le Châtelier).
Influence d'un catalyseur
Définition d'un catalyseur
Un catalyseur est une espèce chimique, introduite dans le milieu réactionnel, qui a pour effet d'augmenter la vitesse de réaction sans figurer dans l'équation de la réaction (voir dernier chapitre: la catalyse).
Catalyse des réactions d'estérification et d'hydrolyse de l'ester
Les ions oxonium (H3O+ ou plus simplement H+) catalysent aussi bien la réaction d'estérification que la réaction inverse. Ils sont fréquemment introduits dans le milieu réactionnel par l'acide sulfurique ou l'acide paratoluènesulfonique.
Ce catalyseur permet d'atteindre plus rapidement l'état d'équilibre sans changer la composition du milieu réactionnel à l'équilibre.
Rappel : les ions oxonium et le pH
Le pH, ou encore potentiel hydrogène, correspond à une mesure de l'activité chimique de ce qu'on appelle les hydrons dans une solution. Mais vous les connaissez plus certainement sous le nom de protons ou encore ions hydrogènes. De façon plus particulière, ces protons, dans une solution aqueuse, se présentent sous la forme de l'ion hydronium qui représente le plus simple des ions oxonium. Le pH est, le plus souvent, utilisé afin de mesurer l'acidité ou encore la basicité de la solution. On peut alors la déterminer avec l'échelle suivante dans le cas d'un milieu aqueux à 25°C :
- Une solution de pH égal à 7 est considérée comme étant neutre ;
- Une solution de pH inférieur à 7 est considérée comme étant acide. De ce fait, plus son pH diminue, plus elle est acide ;
- Une solution de pH supérieur à 7 est considérée comme étant basique. De ce fait, plus son pH augmente, plus elle est basique.

La chaleur est un catalyseur naturel de nombreuses réactions chimiques.
L’hydrolyse : la réaction inverse
L’hydrolyse d’un ester est la réaction inverse de l’estérification :
Ester + Eau ⇌ Acide carboxylique + Alcool
C’est aussi une réaction lente et limitée.
En milieu basique, elle devient totale : on parle de saponification. C’est le principe de la fabrication du savon à partir d’huiles ou de graisses naturelles, où les esters (triglycérides) sont hydrolysés en sels d’acides gras et en glycérol.
| Caractéristique | Estérification | Hydrolyse de l’ester |
|---|---|---|
| Définition | Réaction entre un acide carboxylique et un alcool pour former un ester et de l’eau | Réaction entre un ester et de l’eau pour former un acide carboxylique et un alcool |
| Equation générale | R—COOH + R’—OH → R—COO—R’ + H₂O | R—COO—R’ + H₂O → R—COOH + R’—OH |
| Sens de la réaction | Formation de l’ester | Formation de l’acide et de l’alcool |
| Nature de la réaction | Athermique | Athermique |
| Influence de la température | Augmente la vitesse de réaction mais pas l’équilibre | Augmente la vitesse de réaction mais pas l’équilibre |
| Point d’équilibre | La réaction est limitée par la réaction inverse (hydrolyse) | La réaction est limitée par la réaction inverse (estérification) |
| Utilisation typique | Synthèse d’esters parfumés, solvants, plastiques | Saponification, récupération d’acides ou alcools |
Les triglycérides et les acides gras
Les triglycérides sont des triesters issus d’un glycérol et de trois acides gras.

Pour votre santé, il est préférable de limiter la consommation de graisses saturées.
Glycérol
Le glycérol est un triol (trois groupes –OH). Il est très soluble dans l’eau grâce aux liaisons hydrogène qu’il peut former avec les molécules d’eau.
Acides gras
- Saturés : chaînes linéaires avec uniquement des liaisons simples, riches en hydrogène.
- Insaturés : une ou plusieurs doubles liaisons dans la chaîne carbonée.
Exemple de réaction :
3 R–COOH + Glycérol → Triglycéride + 3 H₂O
Le nom du triglycéride vient de l’acide gras avec la terminaison –ine.
Exemple : acide oléique → oléine.
Les triglycérides sont sensibles à l’oxydation (rancissement) et à la chaleur élevée (décomposition en acroléine et vapeur inflammable).
L’état d’équilibre chimique
Lorsqu’une réaction directe et sa réaction inverse se produisent à la même vitesse, le système atteint un équilibre dynamique.
Dans le cas de l’estérification, les quatre espèces (acide, alcool, ester et eau) coexistent en proportion constante.
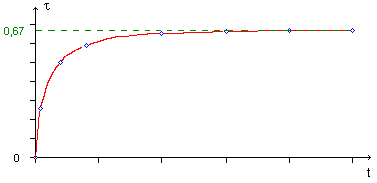
Exemple de courbe illustrant l’évolution du taux d’avancement de la réaction.
Polarité, géométrie et interactions intermoléculaires
Théorie VSEPR
La théorie VSEPR décrit la géométrie moléculaire en fonction de la répulsion des doublets électroniques : AXₙEₘ.
- H₂O → AX₂E₂ → forme coudée
- CO₂ → AX₂ → forme linéaire
Forces intermoléculaires
- Van der Waals : interactions entre molécules neutres.
- Liaisons hydrogène : interactions fortes dans les molécules polaires.
Formation d'une molécule : la liaison covalente
Définition
Une liaison covalente entre deux atomes correspond à la mise en commun entre ces deux atomes de deux électrons de leurs couches externes pour former un doublet d'électrons appelé doublet liant.
Le doublet liant, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des atomes liés.
Nombre de liaisons covalentes établies par un atome
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
Les forces de Van Der Waals
Nommées ainsi en l'honneur de Johannes Diderik van der Waals, un physicien néerlandais du XIX ème siècle, ces forces peuvent se décrire comme les interactions électroniques entres les atomes ou molécules, qui les lient ensemble.
Johannes Diderik van der Waals fut le premier a les prendre en compte dans es calculs en 1873. Cela lui valut de recevoir en 1910 le prix Nobel de physique.
Ce phénomène s'explique par la répartition des charges au sein d'une molécule ou au sein des couples d'atomes. Pour plus de détails, il faut néanmoins se plonger dans la physique quantique pour en comprendre les principes les plus poussés.
On peut leur trouver trois origines :
- L'interaction électrostatique attractive entre deux multipôles induits, il s'agira dans ce cas des forces de London ;
- L'interaction attractive entre un multipôle permanent et un multipôle induit et il s'agira des forces de Debye ;
- L'interaction électrostatique attractive ou répulsive entre deux multipôles permanents selon leurs orientations, il s'agit alors des forces de Keesom.
Les exemples les plus flagrants des effets des forces de Van Der Waals sont les absorptions par capillarité ainsi que les systèmes d'accroche des pattes de gecko qui peuvent coller aux murs.
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour monsieur le professeur, j’aimerais savoir les différentes sortes d’esterification au glycérol
Et quels sont les caractéristiques du glycérol.
J’ai aimer l’explication elle était très compréhensif dés la lecture