Chapitres
- 01. Généralités
- 02. L'oxydation des alcools
- 03. Nomenclature
- 04. La théorie VSEPR
- 05. Rappels
- 06. Les boissons alcoolisées
- 07. L'éthanol
- 08. Exercice 1
- 09. Exercice 2
- 10. Exercice 3
- 11. Exercice 4
- 12. Exercice 5
- 13. Exercice 6
- 14. Exercice 7
- 15. Exercice 8
- 16. Exercice 9
- 17. Exercice 10
- 18. Exercice 11
- 19. Exercice 12

Généralités

Les alcools sont identifiables grâce à la fonction organique alcool. Elle consiste en un groupe -OH lié à l'un des carbones de la chaîne carbonée d'un alcane. En réalité, il y a trois classes d'alcools. On les distingue en fonction du nombre de groupes alkyles auxquels il est lié. On reviendra plus tard sur l'importance de la distinction des alcools selon leur classe. Le tableau de synthèse à retenir est le suivant :
| Formule générale | Classe | Exemple | Nom |
|---|---|---|---|
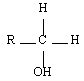 | Primaire | 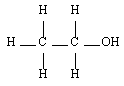 | Ethanol |
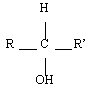 | Secondaire | 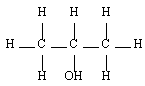 | Propan-2-ol |
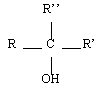 | Tertiaire | 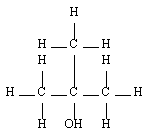 | Méthyl-propan-2-ol |
L'oxydation des alcools

On a déjà pu étudier la signification du terme d'oxydation et les particularités de la réaction qu'il recouvre. Dans le cas précis de l'oxydation des alcools, il faut noter que l'on parle d'oxydation ménagée parce qu'il n'y a pas de rupture des liaisons entre les atomes de carbones. Ces liaisons sont maintenues aussi ne parle-t-on pas d'une réaction complète puisque la destruction de ces liaisons n'a pas lieu.
Il s'agit d'une réaction ménagée parce qu'elle conserve le squelette carboné de la molécule.
La classe de l'alcool qui subit l'oxydation ménagée va déterminer la nature de ses produits :
- Les alcools tertiaires ne peuvent pas subir d'oxydation ménagée.
- L'oxydation ménagée des alcools primaires et secondaires peut se faire par trois moyens :
- Par un oxydant en milieu acide (par exemple le permanganate de potassium)
- Par le dioxygène de l'air en présence d'un catalyseur.
- Par déshydrogénation sur du cuivre ou du platine en présence d'un catalyseur.
On arrive à des résultats différents selon la classe de l'alcool qui a été utilisé comme réactif. Certains des produits d'une oxydation ménagée peuvent eux-mêmes subir une réaction d'oxydation ménagée. C'est notamment cette propriété qui nous permettra de tester le produit de la première oxydation ménagée et donc d'en déduire la classe de l'alcool qui l'a subie.
| Classe de l'alcool | Produit de son oxydation | Produit de l'oxydation du produit de son oxydation |
|---|---|---|
| Primaire | Aldéhyde | Acide carboxylique |
| Secondaire | Cétone | Pas d'oxydation ménagée des cétones |
| Tertiaire | Pas d'oxydation ménagée des alcools tertiaires | |
Nomenclature

Lorsque l'alcool est la fonction principale de la molécule que l'on cherche à nommer, il suffit alors de remplacer la voyelle terminale « e » de l'alcane correspondant à l'alcool que l'on cherche à nommer par le suffixe -ol. Il est ensuite nécessaire d'indiquer le numéro de l'atome de carbone où le groupe hydroxyle est fixé. Même si cette précision n'est pas toujours nécessaire, il est alors possible d'omettre cette précision pour une lecture plus digeste.
Si la fonction alcool n'est pas la fonction principale de la molécule, il faut alors ajouter le préfixe hydroxy- précédé du numéro de l'atome de carbone où le groupe est fixé.
Ensuite, pour nommer la base conjuguée de l'alcool, comme l'ion alcoolate, il suffit simplement de remplacer la voyelle terminale « e » par le suffixe -olate. Veillez à ne pas confondre avec le suffixe -oate qui est plutôt caractéristique du carboxylate, correspondant alors base conjuguée de l'acide carboxylique.
Où trouver un professeur de physique chimie ?
La théorie VSEPR
La théorie VSEPR , signifiant en Anglais Valence Shell Electron Pair Repulsion, encore noté RPECV en Français, signifie « répulsion des paires électroniques de la couche de valence ». Cette théorie correspond à une méthode destinée à prédire la géométrie des molécules. Cela est possible en se basant sur la théorie de la répulsion des électrons de la couche de valence, également connue sous le nom de « théorie de Gillespie »
Comment progresser en cours physique chimie college ?
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions qui concernent principalement la nature des liaisons entre atomes :
- les atomes dans une molécule sont liés par des paires d'électrons ;
- deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples ;
- certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants ;
- les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces ;
- les doublets non liants occupent plus de place que les doublets liants ;
- les liaisons multiples prennent plus de place que les liaisons simples.
Notation
Dans la théorie VSEPR, il y a certains usages de notation à respecter :
- On note l'atome central de la molécule étudiée A.
- Les doublets non-liants, et donc les paires d'électrons appartenant à l'atome central A qui se sont pas impliqués dans les liaisons sont notés E et m leur nombre.
- Les doublets liants, et donc paires d'électrons qui sont impliqués dans des liaisons entre l'atome central A et un autre atome sont notés X. Le nombre de doublets liants sera noté n.
Le professeur de physique le dira, les molécules simples, dont la géométrie est facilement définissable grâce à la méthode VSEPR sont donc notés suivant la notation vu ci-dessus et se présentent donc sous la forme : AXnEm
Rappels
Les réactions d'oxydo-réduction
Une réaction d'oxydoréduction, également appelée réaction redox, correspond à une réaction chimique au cours de laquelle a lieu un transfert d'électron. C'est-à-dire une réaction durant laquelle une espèce chimique dite oxydant reçoit un ou plusieurs électrons d'une autre espèce chimique dite réducteur.
Un oxydant, également appelé agent d'oxydation, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, reçoit un ou plusieurs électrons d'une autre espèce chimique. Lavoisier mettra en évidence en 1772, suite à ses manipulations du mercure, le rôle du dioxygène dans certaines réactions d'oxydoréduction. D'où le nom oxydation qui signifie "combinaison avec l'oxygène".
Un réducteur, également appelé agent de réduction, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, cède un ou plusieurs électrons à une autre espèce chimique. Réduction quant à lui signifie "l'extraction d'un métal de son oxyde", une définition connue en métallurgie.
Les réactions d'oxydo-réduction forment une grande famille puisqu'elles comprennent de nombreuses réactions chimiques. En effet, elles interviennent dans les combustions, certains dosages métallurgiques mais également la corrosion des métaux, l'électrochimie et la respiration cellulaire.
Ces réactions sont alors essentielles puisqu'elles jouent un rôle fondamental en biologie : elles permettent la transformation de l'oxygène en eau, de formule H2O, au sein des organismes vivants. Elles sont également massivement utilisées dans l'industrie humaine, notamment afin d'obtenir de la fonte à partir de différents minerais composés d'oxyde de fer grâce à une réduction, puis de fer et d'acier à partir de la fonte grâce à une réaction d'oxydation.
Ces différentes utilisations peuvent être expliquée par l'extrême mobilité de l'électron, sa légèreté mais également son omniprésence dans toutes les formes de la matière.
Om trouver des cours de physique en ligne ?
Les demi-équations
Puisque dans une réaction d'oxydo-réduction, le réducteur s'oxyde, c'est la réaction d'oxydation et l'oxydant se réduit, c'est la réaction de réduction, l'oxydoréduction se compose donc de deux demi-réactions : une oxydation et une réduction.
Elles se présentent sous la forme suivante :
- Oxydation
- réducteur(1) = oxydant(1) + n e-
- Réduction
- oxydant(2) + n e- = réducteur(2)
- Oxydoréduction qui représente donc la "somme" de l'oxydation et de la réduction
- oxydant(2) + réducteur(1) → oxydant(1) + réducteur(2)
Notons que dans les demi-équation, les flèches n'apparaissent que si la réaction est totale, c'est à dire quand K > 10 000
Le potentiel d'oxydo-réduction
Le caractère oxydant ou réducteur d'une espèce dépend de la réaction chimique et des espèces qui interagissent entre elles. En effet, l'élément réducteur dans une réaction peut devenir l'oxydant d'une autre réaction. C'est pour cela que l'on construit une échelle de force oxydante (ou de force réductrice selon le sens donné à cette échelle) afin d'obtenir le potentiel d'oxydo-réduction se mesurant en volt.
En outre, le potentiel d'oxydo-réduction dépend du contexte chimique, notamment du pH, mais aussi du contexte physique puisque les effets de la lumière peuvent intervenir dans la nature comme ce qui est le cas avec la photosynthèse chez les plantes ou la photographie avec l'Homme.
Les boissons alcoolisées
En cours physique chimie ts, une boisson alcoolisée, également appelé alcool, correspond à une boisson qui a été fermentée, macérée ou distillées contenant de l'éthanol ou encore un alcool éthylique. Considérée comme étant une drogue dure, elle représente celle qui provoque la plus forte mortalité dans le monde et figure même sur la liste des cancérogènes du groupe 1 du CIRC. On considère l'alcool comme étant responsable de plusieurs millions de morts par an à travers le monde.
Le Centre International de Recherche sur le Cancer, également appelé CIRC et nommé International Agency for Research on Cancer en Anglais, correspond à une agence intergouvernementale de recherche sur le cancer. Elle a été créée en 1965 par l'Organisation mondiale de la santé des Nations unies.
L'Organisation mondiale de la santé, également appelée OMS, correspond à une institution spécialisée de l'Organisation des Nations unies pour la santé publique. Celle-ci a été créé en 1948 et dépend directement du Conseil économique et social des Nations unies. Son siège se situe à Genève en Suisse, sur la commune de Pregny-Chambésy.
La consommation d'alcool provoque chez l'Homme un effet psychotrope que l'on appelle ivresse ou encore intoxication alcoolique mais aussi un risque de dépendance que l'on appelle alcoolisme ou encore alcoolodépendance et d'autres problèmes pour la santé et des risques sociaux comme la violence ou encore les accidents de la route. C'est pour cela que la majorité des pays possède une législation qui réglemente la production, mais également la vente et la consommation de ces boissons alcoolisées. Certains pays ont même opté pour une interdiction totale des boissons alcoolisées même si, dans certains autres pays, la consommation d'alcool est ancrée très profondément dans la culture et poussent donc l'alcool au rang de drogues récréatives la plus ancienne dont la consommation est très fortement banalisée.
Retrouvez tous nos cours physique paris.
L'éthanol

si vous voulez rouler avec ce carburant, il est néanmoins possible d'effectuer quelques modifications afin que votre moteur puisse fonctionner avec du bioéthanol sans pour autant se dégrader.
L'éthanol, également appelé alcool éthylique, correspond à un alcool dont la formule semi-développée est CH3-CH2-OH. L'éthanol est un liquide incolore, volatil, miscible à l'eau en toutes proportion et inflammable en plus d'avoir des propriétés psychotropes très connue car l'éthanol correspond à la drogue récréative la plus ancienne lorsqu'il est sous la forme de boissons alcoolisées.
Cette molécule est très utilisée par l'industrie agroalimentaire afin de produire des spiritueux mais également par la parfumerie et la pharmacie galénique qui utilise l'éthanol comme solvant. Aujourd'hui, l'éthanol est également très utilisé sous la forme de bioéthanol afin de s'en servir comme biocarburant. Vous pouvez également le retrouver dans les thermomètres à alcool.
Exercice 1
Il est possible de faire réagir de la vapeur d'eau sur l'éthylène. Pour cela, on fait passer le mélange d'éthylène et de vapeur d'eau maintenu à 300°C et sous 70 bars sur un catalyseur favorisant la réaction d'hydratation de l'éthylène.
- Ecrire le schéma de cette réaction et préciser le nom du corps obtenu. Comment opère- t – on pour obtenir un bon rendement ?
- En utilisant des conditions expérimentales analogues aux précédents, on se propose d’hydrater les alcènes suivants :
- butèn-2
- propène
Ecrire les formules des alcools qu'on est, en principe, susceptible d’obtenir. Les nommer.
Prêt pour un cours physique chimie 1ere s ?
Correction
- C2H4(g)+ H2O(g) = C2H5OH(g) On obtient ainsi de l'éthanol gazeux. Pour améliorer le rendement, il faut bien choisir la verrerie afin de minimiser les incertitudes, ainsi qu'ajouter les réactifs en proportions stœchiométriques afin qu'ils soient totalement consommés.
- Le mélange du butène-1 et des butènes-2 conduit au même alcool, l’alcool sec-butylique. Les deux méthyl-2-butènes-1 et -2 s’hydratent pour donner le même alcool, le méthyl-2-butanol-2
- En réalisant l'hydratation du propène en milieu acide, on obtient un mélange de deux alcools, le propan-1-ol et le propan-2-ol
Exercice 2
Des isomères de masse molaire moléculaire M = 72 g réagissant avec la D.N.P.H
- Déterminer le groupement fonctionnel et les formules brutes de ces composés sachant que ceux-ci n'ont que ce groupement fonctionnel et que la chaîne carbonée ne présente que des simples liaisons carbone-carbone.
- Donner les formules développées et les noms possibles des isomères.
- Quelles sont les réactions chimiques envisageables pour identifier les différents groupements fonctionnels des isomères. (Préciser les réactions en citant les réactifs et les produits sans écrire les équations-bilans.)
Correction
- La formule brute de ce type de composé saturé est : CNH2nO dont le groupement fonctionnel est la cétone. En effet, le test à la DNPH indique effectivement la présence d'un groupe carbonyle (un atome d'oxygène lié à par une double liaison à un atome de carbone trigonal). Ainsi, il est aisé de se rendre compte qu'en réécrivant les formules générales des aldéhydes et des cétones, on arrive facilement à la conclusion que leur formule brute est CNH2nO
- M(CnH2nO) = M(C)*n + M(H)*2*n + M(O) = 72
- M(CnH2nO) = 12*n + 1*2*n + 16 = 72
- Donc 14n=56 et n=4 et la formule brute de ces isomères est : C4H8O
Exercice 3
Dans plusieurs régions de France, on fabrique du vin d’épines, un apéritif alcoolisé qui titre environ à environ 15 % en degré d’alcool. Cette boisson est préparée en faisant macérer de jeunes pousses de prunellier, un petit arbre rustique, dans un mélange de sucre, de vin et d’eau de vie* pendant un mois. Après filtration, ce mélange est mis en bouteille pour vieillir pendant au moins trois mois, avant de pouvoir être dégusté. En fin de période de vieillissement, il est possible de vérifier le degré d’alcool du vin d’épines fabriqué en réalisant un titrage suivi par colorimétrie.
On considère que l'alcool présent dans les boissons alcoolisées est une seule et même espèce chimique : l’éthanol.
Le degré d’alcool d’une boisson alcoolisée, noté (°), correspond au volume d'éthanol pur contenu dans 100 mL de boisson. Par exemple,100 mL d’une boisson à 35° contient 35 mL d’éthanol pur.
*boisson alcoolisée obtenue par distillation de jus fermentés de fruits, de céréales ou de tubercules.
L’objectif de cet exercice est d’étudier quelques propriétés de l’éthanol et de déterminer le degré d’alcool d’un vin d’épines.
Enoncé : Détermination du degré d’alcool du vin d’épines
Le vin d’épines étant constitué de diverses espèces chimiques, on effectue une distillation fractionnée d’un mélange de 50 mL de vin d’épines et d’eau pour en extraire l’éthanol. On verse le distillat dans une fiole jaugée de 500 mL et on complète avec de l’eau distillée. On obtient 500 mL de solution notée S contenant tout l’éthanol initialement présent dans 50 mL de vin d’épines.
L’éthanol réagit avec les ions permanganate en milieu acide, mais cette transformation, quoique totale, est lente : elle ne peut donc pas être le support d’un titrage. On procède donc en deux étapes.
Étape 1 : on introduit les ions permanganate en excès dans un volume donné de la solution S pour transformer tout l’éthanol présent en acide éthanoïque et on laisse le temps nécessaire à la transformation de s’effectuer.
Étape 2 : on réalise ensuite le titrage des ions permanganate restants par les ions Fe2+.
Données :
- Couples oxydant-réducteur :
- acide éthanoïque / éthanol : C2H4O2(aq) / C2H6O (aq)
- ion permanganate / ion manganèse : MnO4-(aq) / Mn2+(aq)
- Demi-équation électronique : MnO4-(aq) + 8 H+(aq) + 5 e- = Mn2+(aq) + 4 H2O(l)
- Masse volumique de l’éthanol : 0,79 g.mL-1
- Masse molaire de l’éthanol : M = 46 g.mol-1
- Toutes les espèces chimiques en solution sont incolores mis à part les ions permanganate qui sont violets.
On s’intéresse ici à la réaction entre les ions permanganate et l’éthanol.
Dans un erlenmeyer, on mélange V0 = 2,0 mL de solution S et V1 = 25,0 mL d'une solution acidifiée de permanganate de potassium (K+(aq) +MnO4- (aq)) de concentration en quantité de matière C1 = 5,00.10–2 mol.L–1 .
On bouche l'erlenmeyer et on laisse réagir pendant environ 30 minutes, à 60°C.
Établir que l’équation de réaction entre l’éthanol et les ions permanganate en milieu acide s’écrit : 5 C2H6O(aq) + 4 MnO4-(aq) + 12 H+(aq) → 5 C2H4O2(aq) + 4 Mn2+(aq) + 11 H2O (ℓ)
Correction
Couple : MnO4-(aq) / Mn2+(aq) (×4) MnO4-(aq) + 8 H+(aq) + 5 e– = Mn2+(aq) + 4 H2O(l)
Couple : C2H4O2(aq) / C2H6O (aq) (×5) C2H6O (aq) + H2O(l) = C2H4O2(aq) + 4 H+(aq) + 4 e–
4MnO4-(aq) + 32H+(aq) + 20e– + 5C2H6O (aq) + 5H2O(l) → 4Mn2+(aq) + 16H2O(l) + 5C2H4O2(aq) + 20 H+(aq) + 20e-
4MnO4-(aq) + 32H+(aq) + 5C2H6O (aq) + 5H2O(l) → 4Mn2+(aq) + 16H2O(l) + 5C2H4O2(aq) + 20 H+(aq)
4MnO4-(aq) + 32H+(aq) + 5C2H6O (aq) → 4Mn2+(aq) + 11H2O(l) + 5C2H4O2(aq) + 20 H+(aq)
4MnO4-(aq) + 12H+(aq) + 5C2H6O (aq) → 4Mn2+(aq) + 11H2O(l) + 5C2H4O2(aq)
Exercice 4
Soient 3 flacons contenant chacun une solution aqueuse d'alcool. On sait que ces alcools ont la même formule brute, une seule fonction alcool, et qu'ils appartiennent à des classes différentes.
- Dans une première étape, on cherche à déterminer la classe de ces alcools. Pour cela, on dispose d'une solution de dichromate de potassium acidifiée, de BBT, de D.N.P.H., de liqueur de Fehling et de nitrate d'argent ammoniacal.
Quels tests proposez – vous de faire pour déterminer la classe de ces 3 alcools ?
- Après avoir identifié le flacon contenant l'alcool primaire, on réalise l'expérience suivante :
On oxyde 2,2 g d'alcool primaire avec un excès d'oxydant. L'acide obtenu est dosé : à l’équivalence, on a versé 25 cm3 d'une solution aqueuse d'hydroxyde de sodium, de concentration molaire volumique C = 1 mol. L-1.
En déduire la masse molaire moléculaire de l'alcool et sa formule brute.
- Donner une formule développée possible pour chacun des trois alcools et préciser leur nom et leur classe
Correction
Pour déterminer la classe d'un alcool, il suffit de procéder à son oxydation ménagée.
On arrive à des résultats différents selon la classe de l'alcool qui a été utilisé comme réactif. Certains des produits d'une oxydation ménagée peuvent eux-mêmes subir une réaction d'oxydation ménagée. C'est notamment cette propriété qui nous permettra de tester le produit de la première oxydation ménagée et donc d'en déduire la classe de l'alcool qui l'a subie.
Dans le cas d'un alcool primaire, l'oxydation ménagée donnera un Aldéhyde qui, si il subit une autre réaction d'oxydation donnera un Acide Carboxylique.
Dans le cas d'un alcool secondaire, l'oxydation ménagée donnera une Cétone.
Dans le cas d'un alcool tertiaire, l'oxydation ménagée ne donnera aucun résultat.
Exercice 5
Soit un corps A de formule brute CnH2nO.
- L'oxydation complète de 1 g de A donné 2,45 g de dioxyde de carbone. Déduire n
- Avec la D.N.P.H., A donné précipité jaune. Quelles sont les hypothèses sur la nature de A ?
- Le composé A donné un dépôt d'argent avec le nitrate d'argent ammoniacal. Conclusion ?
- En milieu acide, A est oxydé par le permanganate de potassium et donne l'acide méthyl- 2 propanoïque.
En déduire la nature et la formule développée du corps A ; quel est son nom ?
Correction
Masse de carbone dans 2,45 g de CO2 : 2,45*12/44 = 0,668 g
Masse de carbone dans 1 g de A : 0,668 g soit : 0,668/1*100 = 66,8 %
Masse molaire de A : M=12 n+2n+16 = 14 n+16.
12 n/ 0,668 = M = 14n+16 ; d'où n= 4.
Avec la 2,4 DNPH, A donne un précipité jaune : je conclus que A est un aldéhyde ou une cétone.
CH3-CH2-CH2-CHO butanal
(CH3)2CH -CHO 2-méthylpropanal
CH3-CO-CH2-CH3 butanone
A donne un dépôt d'argent avec le nitrate d'argent ammoniacal : je conclus que A est un aldéhyde.
En milieu acide A est oxydé par le permanganate de potassium et donne l'acide 2-méthylpropanoïque.
A est le 2-méthylpropanal.
Une hydrogénation catalytique de A conduit à B :
(CH3)2CH -CHO + H2 = (CH3)2CH -CH2OH 2-méthylpropan-1-ol.
La réaction de l'acide 2-méthylpropanoïque avec B donne C et de l'eau :
C est un ester : (CH3)2CH -CO2-CH2-CH(CH3)2
2-méthylpropanoate de 2-méthylpropyle.
L'estérification est lente, athermique, limitée par l'hydrolyse de l'ester.
L'acide sulfurique joue le rôle de catalyseur.
L'acide sulfurique doit être concentré sinon l'eau apportée favoriserait l'hydrolyse de l'ester.
Pour obtenir le composé C on peut utiliser un chlorure d'acide ou un anhydride d'acide à la place de l'acide :
(CH3)2CH -COCl : chlorure de 2-méthylpropanoyle.
[(CH3)2CH -CO]2O : anhydride 2-méthylpropanoïque.
Exercice 6
- Un alcène A subi une hydratation en milieu acide. On obtient deux alcools B et B' (B étant en quantité prépondérante).
Ces deux alcools sont isolés et on cherche à les identifier.
B et B' sont mis en présence d'un oxydant : B n'est pas oxydé alors que B' s'oxyde en un composé D qui réagit avec le réactif de Schiff.
Préciser la classe des 2 alcools B et B' ; en déduire la formule de l’alcène A sachant que celui-ci contient 5 carbones.
Le rendement des opérations permettant le passage de A à D est de 8%.
Calculer la masse d'alcène nécessaire à la préparation de 10 g de D.
- A côté du composé D, on note la présence d'un composé organique à fonction acide E. Préciser la formule et le nom de E.
2, 04 g de E et 0,80 g d'hydroxyde de sodium pur réagissent mole à mole. Cette expérience permet – elle de vérifier la formule brute de E ?
Correction
B: est un alcool tertiaire
B':est un alcool primaire
F. S. D de A:C2H5C(CH3)=CH2 qui donne 2-méthylbut-1-ène
F.S.D de E: acide 2-methylbutanoïque
Cette expérience permet de déterminer la formule brute de E oui à l'équivalence avec
nE=nNaOH
M(E) = (m(E) * M(NaOH)) / m(NaOH)
M(E) = (2,04 * 40) / 0,8
M(E) = 102 g/mol
2MnO-4+5C5H12O+6H+
Exercice 7
- On possède cinq flacons contenant les produits notés A, B, C, D et E tous différents. On ne connait pas le nom des cinq produits mais on sait que :
- Chaque produit est un corps pur et sa molécule ne contient que trois atomes de carbone, des atomes d’hydrogène, des atomes d’oxygène ;
- La chaîne carbonée ne comporte pas de liaison multiple ;
- Parmi ces cinq produits il y a deux alcools.
On réalise une oxydation ménagée par le dichromate de potassium en milieu acide des produits A et B et on obtient les résultats suivants : A conduit à C ou D alors que B conduit uniquement à E.
Cette expérience est – elle suffisante pour connaitre les cinq produits A, B, C, D et E ? Justifier votre réponse (un seul argument suffit)
- Pour préciser les résultats précédents on utilise le réactif de Tollens (nitrate d'argent ammoniacal). On constante de C est oxydé.
Décrire l’expérience.
- Identifier les cinq produits, donner leur nom et leur formule semi – développée.
Ecrire, en justifiant les coefficients, l'équation de la réaction d'oxydoréduction par le dichromate de potassium en milieu acide qui fait passer du produit A au produit D. Le couple oxydant réducteur mis en jeu dans le dichromate de potassium est : Cr2O72- / Cr3+.
- On fait réagir ensuite le produit A avec le produit D.
Ecrire l'équation de réaction en utilisant les formules semis- développées.
Donner le nom du produit organique obtenu.
Donner rapidement les principales caractéristiques de cette réaction.
Correction
A est un alcool primaire qui par oxydation ménagée donne un aldéhyde ou un acide carboxylique.
A : propan-1-ol ; C, D : propanal ou acide propanoïque.
B est un alcool secondaire qui donne par oxydation ménagée une cétone.
B : propan-2-ol et E propanone.
On ne peut pas identifier C ou D.
Pour préciser les résultats précédents, on utilise le réactif de Tollens. On constate que C est oxydé.
C est un aldéhyde, le propanal; D est l'acide propanoïque.
A : CH3-CH2-CH2OH ; B : CH3-CHOH-CH3 ; C : CH3-CH2-CHO ; D : CH3-CH2-COOH ; E : CH3-CO-CH3.
3 fois{ C3 H8 O +H2O = C3H6 O2 + 4 électrons + 4H+}.
2 fois{ Cr2O72- + 6 électrons +14 H+ = 2 Cr3+ + 7 H2O}.
3 C3 H8 O +3H2O + 2 Cr2O72- +28 H+ donne 3 C3H6 O2 + 4Cr3+ + 12 H+ + 14 H2O
On fait ensuite réagir le produit A avec le produit D
Estérification lente et limitée par l'hydrolyse de l'ester.
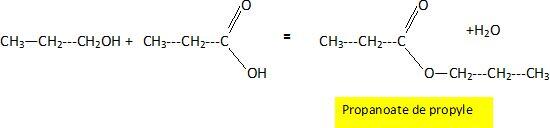
Exercice 8
Les alcools se forment naturellement par fermentation de certaines solutions sucrées : le jus de raisin se transforme ainsi en éthanol lors de la fabrication du vin par exemple. Dans l’industrie chimique, bien d’autres procédés conduisent à la production d’alcools, qui seront eux-mêmes à la base de la fabrication de nombreux produits : solvants, polymères, détergents …
Le méthanol est un liquide incolore et inflammable ; il est miscible à l’eau, aux alcools, aux esters et à la plupart des autres solvants organiques.
Pour produire du méthanol, l’hydrogénation du dioxyde de carbone est la voie la plus étudiée actuellement.
Ce procédé peut être modélisé par la réaction chimique dont l’équation est :
CO2 + 3H2 → méthanol + H2O
Le méthanol intervient par exemple dans la production du formaldéhyde, de l’acide acétique ou encore du MTBE (2-méthoxy-2-méthylpropane), lequel est un adjuvant des carburants. Dans de moindres volumes, le méthanol est utilisé dans les piles à combustible DMFC (Direct Methanol Fuel Cell) ou encore dans le traitement des eaux usées.
- Le tableau suivant donne les électronégativités des atomes H, C et O dans l’échelle de Pauling. Justifier le caractère polaire de la molécule de méthanol.
Atome H C O Électronégativité 2,2 2,5 3,4 - Associer chacune des équations ou demi-équations de la liste suivante à un des usages du méthanol cités en exemple.(a) CH3OH + H2O → CO2 + 6 H+ + 6 e–
(b) CH3OH + CO → CH3CO2H
- Dans la demi-équation électronique (a) ci-dessus, le méthanol intervient-il en tant qu’oxydant ou en tant que réducteur ? Justifier votre réponse.
- La synthèse du MTBE peut être modélisée par la réaction d’équation suivante
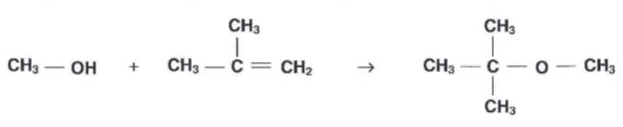
Justifier la réponse.
- La recherche étudie actuellement la voie de production du méthanol citée dans le document 1.Quel(s) intérêt(s) celle-ci présente-t-elle du point de vue du respect de l’environnement
Correction
Le tableau nous montre que l’électronégativité du carbone et de l’hydrogène sont proches, ainsi les liaisons C – H ne sont pas polarisées.
Par contre comme (C) < (O), la liaison C–O est polarisée. Il apparaît une charge partielle négative sur l’atome O et une charge partielle positive sur l’atome C.
De même comme (H) < (O), la liaison O–H est polarisée.
Représentons la molécule de méthanol avec la représentation de CRAM et avec ses charges partielles. 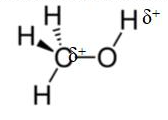
L’équation (a) correspond à la réaction utilisée dans la pile à combustible présentée sur le document 2.
L’équation (b) correspond à la production de l’acide acétique CH3CO2H évoquée en fin de document 1.
La demi-équation (a) est du type Réd = Ox + n e–. Elle décrit l’oxydation du réducteur CH3OH qui libère 6 électrons. Le méthanol est un réducteur.
Les atomes de carbone engagés dans la double liaison sont porteurs de groupes d’atomes identiques (CH3 et CH3 ou H et H), ainsi cet alcène ne présente pas d’isomérie Z/E.
La production de méthanol suivant la réaction d’équation CO2 + 3 H2 à méthanol + H2O permet de consommer du dioxyde de carbone qui est un gaz à effet de serre (mais elle produit de l’eau qui est aussi un gaz à effet de serre, il faut alors que l’eau soit produite sous forme liquide et le reste). Cette réaction valorise le dioxyde de carbone.
Si l’on utilise le méthanol produit par cette réaction dans une pile à combustible, du dioxyde de carbone sera alors produit et il pourrait resservir pour produire à nouveau du méthanol ; tandis que l’on récupèrerait de l’énergie électrique.
Il faut tout de même envisager l’impact environnemental de la production du dihydrogène nécessaire (électrolyse de l’eau avec de l’énergie électrique d’origine solaire ou nucléaire ?).
Exercice 9
On dispose de deux mono-alcools saturés A et B.
- On traite ces deux alcools par une solution diluée de dichromate de potassium en milieu sulfurique. Les deux solutions deviennent vertes. Que peut – on en déduire ?
- Les composés organiques A' et B' extraits respectivement des deux solutions donnent un précipité avec la DNPH. Quelles peuvent être les fonctions de A' et B' ?
- On répète les expériences précédentes avec d'autres échantillons des deux alcools, mais avec une solution concentrée de dichromate de potassium en excès. Les produits organiques obtenus sont notés A'' et B''. A'' donne un précipité avec la DNPH alors que A'' et A' sont identiques.
- Quelles sont les fonctions de A'' et B'' ? Montrer que A'' et A' sont identiques.
- A comporte le minimum d'atomes de carbone compatible avec sa classe. Donner les noms et les formules semi-développées de A et A'.
- La masse molaire moléculaire de B'' est 88 g.mol-1. Déterminer la formule moléculaire de B''. Donner les formules semi – développées et les noms des isomères possibles pour B''et pour B.
Correction
La formule brute d'un monoalcool saturé correspond à CnH2n+2O
Les alcools ont été oxydés, nous sommes dont en présente d'alcools primaire ou secondaire et non pas en présence d'un alcool tertiaire puisque les alcools tertiaire ne réagissent pas si on essaie de procéder à une oxydation et donc ne subissent pas d'oxydation ménagée.
Puisque que l'on obtient un précipité avec la DNPH, on peut en conclure que A' et B' sont des aldéhydes ou cétones. En effet, le groupement carbonyl a été mis en évidence par la présence du précipité.
Or, on sait que l'oxydation ménagée (oxydant en défaut) d'un alcool primaire donne un aldéhyde tandis que l'oxydation ménagée d'un alcool secondaire donne une cétone.
On peut donc en conclure que A" est une cétone donc A correspond à un alcool secondaire.
Or, l'oxydation ménagée (oxydant en excès) d'un alcool primaire donne un acide carboxylique
On peut donc en conclure que B" est un acide carboxylique donc B correspond à un alcool primaire
A noter qu''il y ait excès ou défaut d'oxydant l'oxydation ménagée d'un alcool secondaire s'arrête à la cétone. On peut donc en conclure que A' est identique à A"
Or, pour un alcool secondaire il faut au moins 3 carbone (propan-2-ol CH3-CHOH-CH3 donne propanone ou acétone CH3-CO-CH3)
Exercice 10
Les esters sont des composés organiques volatils souvent utilisés pour produire des arômes et des fragrances synthétiques. L’ester étudié dans cet exercice est l’acétate d’isoamyle, un ester dont la saveur et l’odeur sont ceux de la banane.
L’équation de la réaction de synthèse, en présence d’acide sulfurique, s’écrit : 
L’objectif de cet exercice est de comparer plusieurs protocoles de synthèse de l’acétate d’isoamyle.
Données :
- Caractéristiques physico-chimiques :
Espèces chimiques Propriétés physiques Alcool isoamylique M = 88,1 g.mol-1
Teb = 128 °C
r = 0,81 g.mL-1
Très peu soluble dans l’eauAcide acétique M = 60,1 g.mol-1
Teb = 118 °C
r = 1,05 g.mL-1
Très soluble dans l’eauAcétate d’isoamyle M = 130,2 g.mol-1
Teb = 142 °C
r = 0,87 g.mL-1
Très peu soluble dans l’eauAcide sulfurique Très soluble dans l’eau - Electronégativité de quelques éléments :
Atome H C O Électronégativité 2,2 2,5 3,4 - Chimie verte :
La notion de chimie verte date de 1991, l’agence américaine pour la protection de l’environnement en propose la définition suivante : « la chimie verte a pour but de concevoir des produits et des procédés chimiques permettant de réduire ou d’éliminer l’utilisation et la synthèse de substances dangereuses » et énonce les 12 principes :- Prévention
- Économie d'atomes
- Synthèses chimiques moins nocives
- Conception de produits chimiques plus sécuritaires
- Solvants et auxiliaires plus sécuritaires
- Amélioration du rendement énergétiques
- Utilisation de matières premières renouvelables
- Réduction des sous-produits et intermédiaires
- Utilisation de catalyseurs non polluants
- Conception de substances non persistantes
- Analyse en temps réel pour éviter tout risque de pollution
- Chimie sécuritaire pour prévenir les accidents
- Rayonnement micro-ondes :Un four à micro-ondes est un appareil électroménager utilisé principalement pour le chauffage rapide d’aliments, par agitation des molécules d’eau qu’ils contiennent, ces molécules absorbant le rayonnement de fréquence 2,45 GHz émis par le four. Cette technologie est principalement utilisée dans la cuisine mais, depuis une vingtaine d’années, les fours à micro-ondes sont largement utilisés dans les laboratoires de chimie pour activer des réactions chimiques. […] Cette application peut être considérée comme faisant partie de la « chimie verte ».
- Spectre des ondes électromagnétiques :
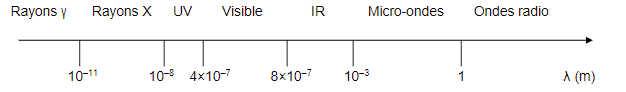
Questions
Réaction de synthèse de l’acétate d’isoamyle et mécanisme réactionnel
Quels sont les noms, en nomenclature officielle, de l’acide acétique et de l’alcool isoamylique ?
Les deux premières étapes du mécanisme réactionnel de synthèse de l’acétate d’isoamyle sont données ci-dessous. 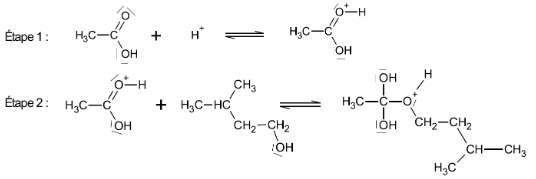
Compléter le mécanisme réactionnel de l’étape 2 à l’aide de flèches courbes, puis indiquer la catégorie de réaction de l’étape 2.
Les ions H+, provenant de l’acide sulfurique, jouent le rôle de catalyseurs de la réaction. Que peut-on attendre lors d’une autre étape du mécanisme réactionnel de cette réaction de synthèse ?
Correction
Réaction de synthèse de l’acétate d’isoamyle et mécanisme réactionnel
L’acide acétique se nomme acide éthanoïque.
L’alcool isoamylique se nomme 3-méthylbutan-1-ol.

Deux réactifs, dont l’un avec une liaison double, conduisent à la formation d’un seul produit. Cette étape 2 correspond à une réaction d’addition.
Justification des flèches courbes non demandée :
Formation de la liaison C–O : L’atome d’oxygène de l’alcool possède des doublets non liants, il est riche en électrons et est le site donneur de doublets.
L’atome de carbone central de l’acide est lié à des atomes d’oxygène plus électronégatifs que lui. Il est appauvri en électrons et est porteur d’une charge partielle positive. C’est le site accepteur.
Rupture de la double liaison C=O de l’acide :
L’atome d’oxygène est plus électronégatif que l’atome de carbone, il récupère le doublet.
On sait qu’un catalyseur est régénéré en fin de réaction. On s’attend à ce qu’un ion H+ soit formé au cours d’une étape ultérieure du mécanisme.
Exercice 11
- Donner les formules développées des différents alcools de formule brute C4H10O. Les nommer et indiquer à quelle classe d'alcool ils appartiennent.
- L'un des alcools précédents possède un carbone asymétrique ; Lequel ? Expliquer ce qu'est la chiralité. Dessiner en représentation projective les deux énantiomères correspondants.
- Ce même alcool peut être préparé à partir d'un alcène. Dire par quel type de réaction.
Quel doit être cet alcène pour que l'on obtienne uniquement l'alcool à carbone asymétrique ?
Ecrire l'équation correspondante.
- L'alcool en question peut être oxydé à froid par l'ion dichromate.
Quel corps dérivant de l'alcool obtient- on ?
Comment pourrait – on caractériser ce dernier corps ?
Correction
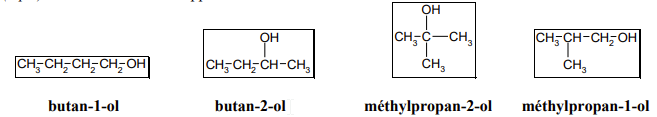
Le composé A1 possède le groupe caractéristique carbonyle (test à la 2,4-DNPH positif) et il s’agit d’un aldéhyde (test à la liqueur de Fehling positif).
Le composé A2 ne possède pas de groupe caractéristique carbonyle (test à la 2,4-DNPH négatif).
Le composé C1 possède le groupe caractéristique carbonyle (test à la 2,4-DNPH positif) et il s’agit d’une cétone (test à la liqueur de Fehling négatif).
A1 est un aldéhyde obtenu lors de l’oxydation ménagée de l’alcool A par les ions permanganate. A ayant pour formule brute C4H10O et A1 possédant un squelette carboné linéaire, A1 est un aldéhyde de chaîne carbonée linéaire à quatre atomes de carbone : il s’agit du butanal de formule semi développée : 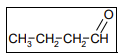
A2 est aussi obtenu lors de l’oxydation ménagée de l’alcool A par les ions permanganate. A2 est un acide carboxylique de squelette carboné linéaire à quatre atomes de carbone : il s’agit de l’acide butanoïque de formule semi-développée : 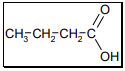
A est un alcool primaire (aldéhyde et acide carboxylique obtenus lors de son oxydation), de formule brute C4H10O et de chaîne carbonée linéaire : A est le butan-1-ol.
B ne réagit pas avec le permanganate de potassium en milieu acide, c’est donc un alcool tertiaire de formule brute C4H10O : B est le méthylpropan-2-ol.
C est un alcool secondaire (cétone obtenue lors de son oxydation), de formule brute C4H10O : C est le butan-2-ol.
C'est le méthylpropan-2-ol qui possède un carbone asymétrique.
La propriété d'une molécule de ne pas être superposable à son image dans un miroir, tout comme la main droite n'est pas superposable à la main gauche, est connue sous le nom de chiralité. C'est pourquoi il est essentiel de distinguer les deux énantiomères d'une molécule chirale.
On peut obtenir un alcool primaire à partir d'un alcène grâce à la déshydratation (ou hydratation acido-catalysée)
Exercice 12
- Un butanol A réduit l'ion dichromate en milieu acide en donnant un composé B qui peut réagir sur la DNPH en produisant un précipité jaune.
Donner les formules développées possibles pour A et B ; préciser le nom des corps correspondants.
- L'alcool initial A est formé de molécules possédant un atome de carbone asymétrique. Quel est cet alcool ? Ecrire sa formule développée et déduire les deux configurations possibles.
Correction
A pourrait être le butan-2-ol ( C4H10O ) et B pourrait être le butanone ( C4H8O )
C'est une molécule de la famille des alcools (-C-O-H) dont la fonction hydroxyle (-O-H) est fixée sur le deuxième atome de carbone de la molécule qui en compte quatre (But = 4).
Le butan-2-ol présente un carbone asymétrique (C*) : CH3-CH2-C*H(OH)-CH3.
Les deux énantiomères du butan-2-ol sont le (S)-butan-2-ol et le (R)-butan-2-ol.
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour comment allez vous je voulais vous demander de m’aider à traiter un exercice
Bonjour,
Nos professeurs particuliers seront heureux de vous aider de manière personnalisée ! N’hésitez pas à les contacter directement sur Superprof.
Bonne journée à vous !
Aide moi à traiter un sujet
Bonjour ! Pour un soutien sur mesure, n’hésitez pas à contacter nos professeurs particuliers sur Superprof. Ils sont prêts à vous aider selon vos besoins pour atteindre vos objectifs ! Bonne journée !
Merci pour votre optimisation .
Le livre en programme pcla correction supernova
J’aime bien comprendre plus
J’aime positivement votre site.je suis sa m’intéresse beaucoup