Chapitres

Exercice 1 : Questionnaire sur la physique
Cet exercice est un QROC (questions à réponses ouvertes et courtes). À chaque affirmation, correspond une seule bonne réponse. Votre choix doit impérativement être accompagné de justifications ou de commentaires brefs (définitions, calculs, exemples ou contre-exemples...) - à l’exception des questions pour lesquelles l’énoncé précise « Aucune justification demandée ».
1 - Autoprotolyse de l’eau.
1.1. L’équation de la réaction d’autoprotolyse de l’eau est :
1.1.1. H3O+ + HO- = 2 H2O
1.1.2. H2O + H2O = H3O+ + HO-
1.1.3. 2 H2O + 2 e- = H2 + 2 HO-
Aucune justification demandée
1.2. La constante d’équilibre associée à l’équation de la réaction d’autoprotolyse de l’eau est appelée :
1.2.1. le produit de solubilité de l’eau.
1.2.2. le quotient de réaction de l’eau.
1.2.3. le produit ionique de l’eau.
Aucune justification demandée

1.3. On peut également interpréter cette constante d’équilibre comme :
1.3.1. la constante d’acidité du couple H2O / HO-.
1.3.2. la constante d’acidité du couple H3O+/ H2O.
1.3.3. la constante d’acidité du couple H3O+/ HO-.
2 - On met en présence 0,6 mole d’acide carboxylique et 0,6 mole d’alcool puis, sans intervenir en aucune façon, on laisse évoluer le mélange maintenu à une température T constante.
Le suivi cinétique de la transformation qui se déroule a permis de tracer les courbes 1 et 2, représentant l’évolution de l’avancement x au cours du temps :
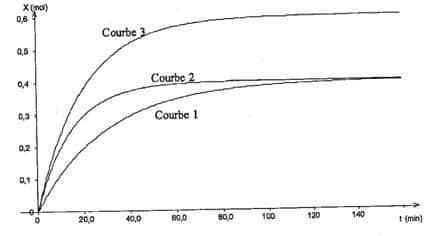
2.1. La vitesse volumique de réaction :
2.1.1. est nulle à l’instant de date t = 0 s.
2.1.2. est maximale à l’instant de date t = 0 s.
2.1.3. est exprimée en mol.min-1.
2.2. La courbe 3 :
2.2.1. peut être obtenue en réalisant la transformation à une température T3 supérieure à T2.
2.2.2. peut être obtenue en réalisant la transformation à une température T3 supérieure à T2 et en présence d’un catalyseur.
2.2.3. ne peut pas être obtenue dans les conditions décrites.
2.3. L’ester obtenu a pour formule semi-développée :
Son nom est :
2.3.1. le propanoate de méthyle.
2.3.2. le méthanoate de propanyle.
2.3.3. le méthanoate de propyle.
Aucune justification demandée
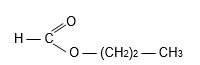
3 - À une transformation chimique est associée la réaction d’équation : 2 A + B = 2 C + 3 D où les espèces chimiques A, B, C et D n’ont pas besoin d’être précisées.
Les mesures ont permis d’établir le tableau d’avancement suivant :
| Avancement | 2A | + B | !ERROR! undefined variable 'c' | +3D | |
|---|---|---|---|---|---|
| Etat initial | 0 | 0,40 | 0,30 | 0 | 0 |
| Etat final | xfinal | 0,30 | 0,25 | 0,10 | 0,15 |
3.1. Le taux d’avancement final de cette transformation est :
3.1.1. t = 0,25
3.1.2. t = 0,50
3.1.3. t = 0,75
3.2. Dans les conditions de l’expérience, la constante d’équilibre K associée à cette équation est K = 1,08
Cette valeur :
3.2.1. dépend de la composition initiale du système.
3.2.2. dépend de la composition initiale du système et de la température.
3.2.3. dépend de la température.
Aucune justification demandée
3.3. Le taux d’avancement final de la transformation :
3.3.1. dépend à la fois de la constante d’équilibre K et de la composition initiale du système.
3.3.2. ne dépend que de la composition initiale du système.
3.3.3. ne dépend que de la constante d’équilibre K.
Aucune justification demandée
4 - On considère un acide noté AH. Lors de la préparation d’une solution aqueuse, la transformation de cet acide avec l’eau est quasi totale. On titre cette solution par une solution aqueuse d’hydroxyde de sodium de concentration molaire en soluté apporté connue.
4.1. L’équation de la réaction de titrage est :
4.1.1. AH + HO- = H2O + A-
4.1.2. H3O+ + HO- = 2 H2O
4.1.3. A- + H3O+ = AH + H2O
4.2. Le suivi pH-métrique de ce titrage a permis d’obtenir la courbe ci-contre :
Pour réaliser un suivi colorimétrique de ce titrage (voir données page suivante) :
4.2.1. seul le bleu de bromothymol convient.
4.2.2. le bleu de bromothymol et le rouge de crésol conviennent.
4.2.3. le bleu de bromothymol, le rouge de crésol et le bleu de bromophénol conviennent.
Données :
| Indicateur coloré | Teinte acide | Zone de virage | Teinte basique |
|---|---|---|---|
| Bleu de bromophénol | jaune | 3,0 à 4,6 | bleu |
| Bleu de bromothymol | jaune | 6,0 à 7,6 | bleu |
| Rouge de crésol | jaune | 7,2 à 8,8 | rouge |
5 - On réalise le montage suivant :
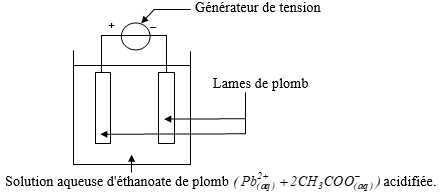
Seul le couple Pb2+/ Pb intervient.
5.1. Ce montage permet de réaliser :
5.1.1. une pile.
5.1.2. une électrolyse.
5.1.3. une transformation spontanée.
5.2. Au bout de quelques minutes, on observe :
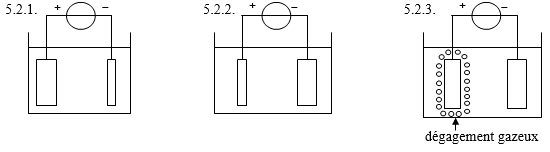
6.1. Une pile est constituée des deux demi-piles suivantes, reliées par un pont salin :
- Une lame de plomb plongeant dans la solution S1 ;
- Une lame de fer plongeant dans la solution S2 ;
On la branche aux bornes d’un conducteur ohmique de résistance R = 100 W.
Après une durée de fonctionnement de 30 minutes :
6.1.1. la masse de la lame de fer a augmenté.
6.1.2. la masse de la lame de fer a diminué.
6.1.3. la valeur de la résistance R n’a aucune influence sur la variation de masse des lames.
6.2. Dans un bécher, on plonge une lame de plomb dans un mélange de 20 mL de la solution S1 et de
20 mL de la solution S2 :
6.2.1. le système n’évoluera pas.
6.2.2. on observera la formation d’un dépôt de fer sur la lame de plomb.
6.2.3. la masse de la lame de plomb va augmenter.
Où trouver des cours de physique en ligne ?
Exercice 2 : La chimie et l'eau de la piscine
L’électrolyse de sel est une des techniques utilisées dans le traitement des eaux d’une piscine. Cette technique permet d’éviter l’utilisation souvent excessive de produits chlorés pour le traitement de l’eau.
Un électrolyseur de sel pour piscine est constitué d’un boîtier électronique et d’une cellule d’électrolyse insérée dans le circuit de filtration. La cellule contient des électrodes de titane recouvertes de métaux précieux : ruthénium et iridium. Quand l’eau circule entre les électrodes aux bornes desquelles est appliquée une tension continue, un courant électrique continu s’établit et l’électrolyse du chlorure de sodium dissous (Na+(aq) + Cl–(aq)) se produit. De l’acide hypochloreux HClO(aq) (appelée chlore actif) est généré indirectement in situ. Cette espèce est particulièrement efficace pour désinfecter l’eau de la piscine.

1. Influence du pH de l'eau de piscine
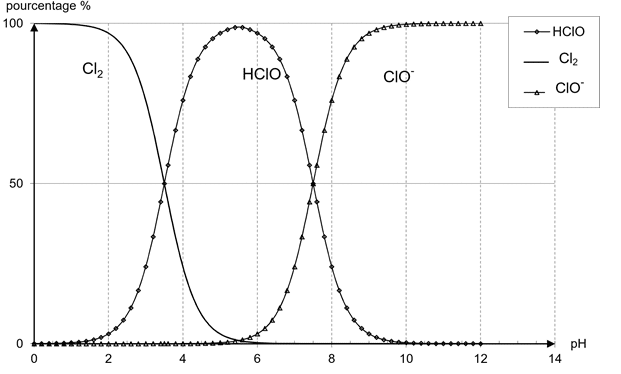
Les quantités de dichlore et des formes acide ou basique de l’acide hypochloreux, en solution, sont fonction du pH de la solution. Ainsi, à 25°C, les proportions de ces espèces en fonction du pH sont données par les courbes de la figure 1.

Le pH d’une eau de piscine doit être compris entre 7,2 et 7,6 pour le confort de la baignade. Pour les deux bornes de cet intervalle de pH, estimer les proportions de chacune des espèces chimiques. Ces proportions correspondent-elles à une désinfection optimale ?
Vous cherchez un professeur de physique chimie ?
2. Dosage des ions chlorure
Pour que l’électrolyse soit efficace, l’eau de piscine doit contenir entre 3 et 5 grammes de sel par litre. Pour s’assurer du bon fonctionnement du système de désinfection de sa piscine, un chimiste prélève un échantillon d’eau de piscine qu’il va analyser dans son laboratoire. Il procède à un dosage conductimétrique des ions chlorure présents dans l’eau de piscine par les ions argent.
L’équation de la réaction support du titrage est la suivante :
Ag+(aq) + Cl–(aq) → AgCl(s)
Protocole du dosage :
- Remplir la burette graduée avec la solution aqueuse titrante de nitrate d’argent
(Ag+(aq) + NO3–(aq)) de concentration en soluté apporté c = 0,050 mol.L-1 ; - Dans un bécher de 200 mL, introduire précisément 10,0 mL d’eau de piscine prélevée et ajouter 90 mL d’eau distillée ;
- Placer, dans le bécher, la cellule conductimétrique reliée au conductimètre ;
- Verser des volumes successifs de 2,0 mL de solution de nitrate d’argent dans le bécher en maintenant en permanence une agitation. Relever après chaque addition la conductivité σ de la solution obtenue et rassembler les résultats dans un tableau.
Données :
Loi de Kohlrausch
La conductimétrie est une méthode d’analyse qui permet de mesurer la conductivité d’une solution, c’est-à-dire son aptitude à conduire le courant électrique.
La conductivité σ d’une solution ionique dépend de la nature des ions Xi présents dans la solution et de leur concentration molaire [Xi].
Ainsi, pour une solution ne contenant que des ions monochargés, notés X1, X2, X3 …, l’expression de la conductivité s’écrit :
σ = λ1.[X1] + λ2.[X2] + λ3.[X3] + … avec σ en S.m-1 ; λi (conductivité molaire de l’ion Xi) en S.m².mol-1 et [Xi] en mol.m-3.
Conductivités molaires ioniques des ions à prendre en considérations pour l’étude :
| Ion | Na+ | Ag+ | Cl- | NO3- |
|---|---|---|---|---|
| λ (mS.m2.mol−1) | 5,01 | 6,19 | 7,63 | 7,14 |
Masses molaires atomiques en g.mol–1: M(Cl) = 35,5 ; M(Na) = 23,0.
2.1. Schématiser et légender le montage expérimental réalisé pour effectuer le dosage conductimétrique.
2.2. Quelles verreries doit-on utiliser pour introduire dans le bécher les 10,0 mL d’eau de piscine à doser, puis les 90 mL d’eau distillée ? Justifier.
2.3. Donner l’expression de la conductivité σ du mélange avant l'équivalence, puis celle après l'équivalence.
2.4. Interpréter qualitativement les variations de la conductivité avant et après l’équivalence.
2.5. Donner l’allure de la courbe de titrage σ = f(VAg+) représentant la conductivité σ du mélange en fonction du volume de solution de nitrate d’argent versé et justifier la position du point d’équivalence sur cette courbe.
Le volume versé à l’équivalence est VE = 15,0 mL.
2.6. En explicitant votre démarche, déterminer la concentration molaire en ions chlorure de l’eau de piscine.
2.7. Est-il nécessaire de rajouter du sel dans la piscine ? Justifier.
Où trouver un professeur de physique pour progresser ?
Exercice 3 : Le miel et la chimie
Le miel est un mélange de composition complexe.
Il est constitué principalement de sucres, dont le fructose et le glucose, d’eau, ainsi que d’autres substances, telles que des acides organiques, des enzymes et des particules solides provenant de sa récolte.
Le miel : un composé riche en sucres.

Lorsque les abeilles ouvrières rapportent le nectar à la ruche, elles le transmettent à des receveuses par trophallaxie (bouche-à-bouche). Celles-ci le font alors transiter plusieurs fois entre leur bouche et leur jabot (petite poche servant de réservoir à nectar) puis le donnent à d’autres receveuses et ainsi de suite. Sous l’effet de l’invertase, une enzyme présente dans le jabot des abeilles, les sucres sont lentement modifiés : le saccharose est hydrolysé en fructose et glucose. Le nectar se transforme ainsi en miel.
Masse volumique de l’eau : ρ = 1,0 g.mL-1 ;
Solubilité du saccharose dans l’eau à 20°C : 2,0 kg.L-1 environ.
1.1. Molécules de glucose et de fructose.
1.1.2. Déterminer les formules brutes du D-glucose et du D-fructose.
1.1.2. Quels sont les points communs entre ces deux molécules ? Quelles sont les différences ? En déduire la relation qui les lie.
1.2. L’hydrolyse du saccharose
Sous l’effet de l’invertase, le saccharose de formule brute est C12H22O11 se transforme en glucose et en fructose dans le jabot des abeilles.
1.2.1. Modéliser, à l’aide des formules brutes, la transformation par une équation chimique. Vérifier qu’il s’agit bien d’une hydrolyse.
1.2.2. L’invertase est le catalyseur de la réaction d’hydrolyse du saccharose.
Citer les différents types de catalyse. Quel type de catalyse est mis en œuvre pour cette hydrolyse dans le jabot des abeilles ?
1.2.3. Les abeilles n’hibernent pas, elles hivernent. Bien que leur activité soit ralentie, elles s’alimentent en consommant le miel stocké dans la ruche. Quand le stock est insuffisant, il faut les nourrir avec des sirops dont la composition est proche de celle d’un miel. Un apiculteur amateur prépare un « sirop léger » par dissolution de 0,50 kg de saccharose dans 1,0 L d’eau à 20°C et l’introduit dans une ruche.
Déterminer la masse de glucose qui sera disponible pour les abeilles lorsqu’elles auront consommé le sirop, l’hydrolyse du saccharose étant considérée comme une réaction totale.
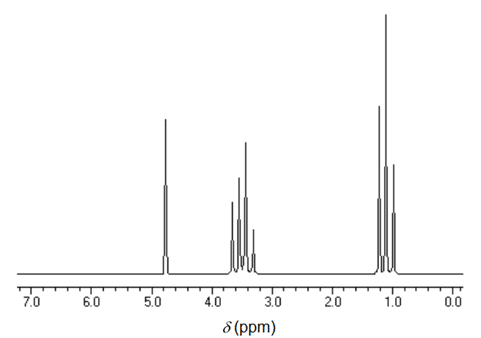
Le glucose est susceptible de fermenter : des microorganismes (levures) produisent une enzyme la zymase qui, par des réactions complexes, conduit le glucose à se décomposer. Cette décomposition est modélisée par l’équation suivante :
Glucose : 2 C2H6O + 2CO2
Le spectre RMN du proton, reproduit ci-dessous, est celui du produit C2H6O formé par fermentation. Donner la formule semi-développée de ce produit.
Justifier votre démarche.
Les propriétés antiseptiques du miel.
Plusieurs acides entrent dans la composition d’un miel. L’acide majoritaire dans le miel est l’acide gluconique, dont la formule est donnée ci-contre. Il provient de la transformation du glucose sous l’action d’une bactérie appelée gluconobacter.
La plupart des miels possèdent un pH compris entre 3,2 et 5,5. De nombreux microorganismes pathogènes (susceptibles de provoquer une maladie ou une infection) ne peuvent croître que si le pH est compris entre 7,2 et 7,4 ; le miel est donc un antiseptique et peut être utilisé pour soigner une plaie.
Donnée :
Constante d’acidité du couple acide gluconique / ion gluconate en solution aqueuse
à 25°C : pKa = 3,3.
- Indiquer la catégorie de réaction correspondant à la transformation du glucose en acide gluconique.
- Écrire la formule de l’ion gluconate en expliquant votre démarche, l’acide gluconique étant considéré comme un monoacide.
- Quelle est l’espèce prédominante dans le miel lorsque le pH est compris entre 7,2 et 7,4 ? Justifier.
L’acidité libre d’un miel.
Un pH trop faible révèle une dégradation biochimique suite à de mauvaises conditions de récolte ou de conservation. Parmi les paramètres spécifiques relatifs à la composition du miel, l’acide libre constitue un critère important de qualité.
La teneur en acidité libre dans un miel est donnée en milliéquivalents par kg (meq.kg-1). Elle correspond à la quantité d’ions hydroxyde en millimoles qu’il faudrait introduire pour amener 1 kg de miel à pH égal à 7. Les normes européennes tolèrent une acidité libre maximale de 40 meq.kg-1.
Protocole pour déterminer l’acidité libre du miel :
- Préparer une solution du miel à tester en dissolvant dans l’eau distillée 6,0 g de miel pour 50,0 mL de solution.
- Ajouter progressivement une solution d’hydroxyde de sodium de concentration Cb= 1,00 × 10–2L-1, en suivant l’évolution du pH.
- Tracer la courbe pH = f(Vb), Vb étant le volume d’hydroxyde de sodium versé.
La courbe obtenue pour le titrage de l’acidité libre du miel analysé est représentée ci-dessous.
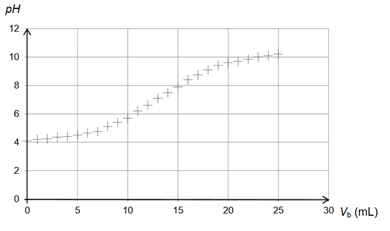
3.1. Rédiger le protocole de préparation des 50,0 mL de solution de miel en précisant la verrerie nécessaire.
3.2. Le miel testé respecte-t-il la réglementation européenne ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite d'être correctement présentée.
Exercice 4 : La chimie et la protection des plantes
Les plantes sont à la base de l'alimentation sur Terre.
Aujourd'hui, une des missions du chimiste est de proposer des produits naturels ou de synthèse permettant de protéger les plantes des insectes et des maladies tout en associant efficacité et respect de l'environnement.
Au-delà de leur mode d'obtention, il s'agit également d'utiliser ces produits de façon raisonnée en respectant les doses conseillées pour inscrire les pratiques agricoles dans une démarche de développement durable.
Chimie et lutte contre les insectes nuisibles pour certaines plantes.

Document 1. Les produits phytosanitaires
Les pesticides sont des substances chimiques destinées à repousser ou à combattre les espèces indésirables de plantes ou d'animaux causant des dommages aux denrées alimentaires, aux produits agricoles, au bois et aux produits ligneux.
Un pesticide est une substance répandue sur une culture pour lutter contre des organismes considérés comme nuisibles. C'est un terme générique qui rassemble les insecticides, les fongicides, les herbicides, les parasiticides. Ils s'attaquent respectivement aux insectes ravageurs, aux champignons, aux
« mauvaises herbes » et aux vers parasites.
Sont également inclus les régulateurs de croissance des plantes, les défoliants, les dessicants, les agents réduisant le nombre de fruits ou évitant leur chute précoce, et les substances appliquées avant ou après récolte pour empêcher la détérioration des produits pendant leur stockage ou leur transport.
Mal utilisés (en termes de quantités) et en raison de leur faible pouvoir de dégradation, les pesticides peuvent s'accumuler dans la chaîne alimentaire et/ou contaminer les milieux naturels.
Document 2. Les insecticides
Au début de la Seconde Guerre mondiale, le DDT (ou dichlorodiphényltrichloroéthane) est rapidement devenu l'insecticide le plus utilisé.
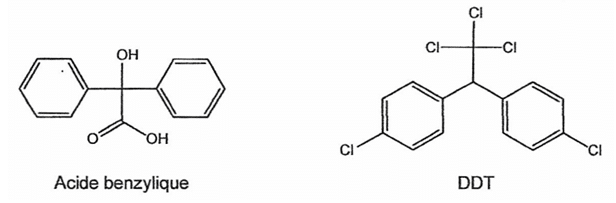
Dans les années 60, des études accusent le DDT d'être cancérigène et reprotoxique (il empêche la bonne reproduction des oiseaux en amincissant la coquille de leurs œufs). Son usage pour l'agriculture est désormais interdit dans la plupart des pays développés, et remplacé par des produits naturels ou de synthèse moins persistants mais plus chers tels que l'acide benzylique de formule chimique très proche du DDT ou des phéromones.
Les phéromones, espèces chimiques ayant des propriétés odorantes agissant à grande distance et à dose infime, sont un moyen de communication chez les insectes.
Les phéromones sexuelles sont les premières qui ont été les mieux étudiées, conduisant à des applications pratiques en agriculture comme l'emploi de «pièges à phéromones » pour lutter contre les insectes. Ces pièges sont composés d'un attractif, un analogue de synthèse de la phéromone naturelle de la femelle de l'insecte à éliminer, et d'un système assurant la capture des mâles. Ils sont actuellement utilisés dans la lutte contre certains lépidoptères.
Par exemple, l'acide 9-hydroxydec-2-éneoïque est une phéromone secrétée par des insectes et utilisée dans certains« pièges à phéromones ». Sa formule topologique est la suivante :
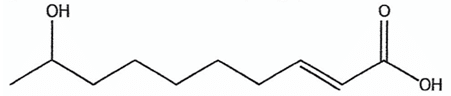
Tous les mécanismes de reconnaissance entre molécules biologiques se font selon le modèle «clé-serrure» : pour qu'une molécule ait un effet biologique, elle doit interagir avec un site récepteur particulier de l'organisme.
Donnée : Comparaison des électronégativités de quelques éléments : χ(H) ≈ χ(C) et χ(C) < χ(O)
Autour de l'acide benzylique :
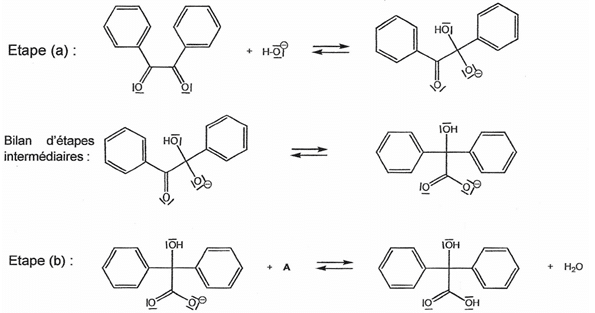
1.1. Recopier la formule de la molécule d'acide benzylique, entourer les deux groupes caractéristiques et indiquer le nom de la fonction organique associée.
1.2. Recopier l'étape (a) du mécanisme réactionnel de la synthèse de l'acide benzylique et la compléter par le tracé des flèches courbes nécessaires. Justifier.
1.3. Dans l'étape (b) du mécanisme réactionnel de la synthèse de l'acide benzylique, identifier le réactif A et préciser la nature de cette réaction. Justifier votre réponse.
Autour d'une phéromone :
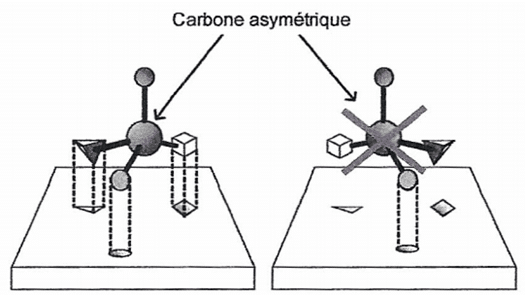
1.4. Sans les représenter, montrer, en argumentant, que l'exemple de phéromone utilisée dans les pièges comporte des énantiomères et des diastéréoisomères.
1.5. Parmi les énantiomères possibles de cette phéromone, un seul est efficace et utilisé dans la constitution des « pièges à phéromones ». Proposer une explication.
Comparaison des modes de protection:
1.6. Quels sont les critères à prendre en compte pour choisir un mode de protection des plantes contre les insectes ? Lequel pourrait être le mieux adapté parmi ceux proposés. Justifier votre réponse.
2. Chimie et lutte contre les maladies de certaines plantations agricoles
Document 5. La chlorose des végétaux
La chlorose des végétaux est une décoloration plus ou moins prononcée des feuilles, due à un manque de chlorophylle. La chlorophylle permet la photosynthèse et donne aux feuilles leur couleur verte.
Le manque de chlorophylle peut provenir d'une insuffisance en magnésium, en fer, en azote, en manganèse ou en zinc, autant d'éléments chimiques indispensables à la synthèse de la chlorophylle.
Dans le commerce, on trouve des solutions dites « anti-chlorose » riches en ions fer (lI) qu'il convient de pulvériser directement sur les plantes et les sols.
Quelques noms commerciaux et caractéristiques des produits « anti-chlorose » :
| Nom du produit commercial | Teneur en fer (g.L−1) | Utilisation référencée |
|---|---|---|
| Fer A 400 LiquidoFer 400 | 40 | Dépôt sur les sols |
| Fer Cler | 25 | Dépôt sur les sols |
| Fer Soni H39F | 20 | Dépôt sur les sols et pulvérisation sur les feuilles |
| FerroTonus | 40 | Dépôt sur les sols |
| PlantoFer 30 | 30 | Dépôt sur les sols |
| FerMi H31 | 10 | Dépôt sur les sols et pulvérisation sur les feuilles |
Une solution inconnue « anti-chlorose » est à disposition d'un jardinier. Afin d'utiliser le plus efficacement possible ce produit, il doit retrouver le fournisseur du produit et ainsi consulter sur son site commercial la dose d'application nécessaire et suffisante pour traiter les rosiers.
Pour cela, il doit doser les ions fer (lI) que la solution contient en suivant le protocole décrit dans le document 6.
Document 6. Protocole de titrage des ions fer (lI) dans une solution « anti-chlorose »
- Diluer 30 fois une solution « anti-chlorose » S contenant les ions Fe2+ de concentration molaire volumique c à déterminer. La solution ainsi obtenue est appelée S' ;
- Introduire dans un erlenmeyer un volume V1 = 20,0 mL de solution S' et de l'acide sulfurique ;
- Réaliser le titrage à l'aide d'une solution titrante de permanganate de potassium de concentration c2 = 5,0×10−3L−1 en ions permanganate MnO4−.
L'équation de la réaction support du titrage s'écrit :
MnO4−(aq) + 5 Fe2+(aq) + 8 H+(aq) à Mn2+(aq) + 5 Fe3+(aq) + 4 H2O(l)
On admet que toutes les espèces chimiques mises en jeu au cours de ce titrage sont incolores ou peu colorées, à l'exception des ions permanganate MnO4− qui donnent au liquide une couleur violette.
Donnée : Masse molaire atomique du fer : M(Fe) = 56 g.mol−1
2.1. En quoi l'usage d'une telle solution peut permettre de lutter contre la chlorose des végétaux ?
2.2. Lors du titrage réalisé, l'équivalence est obtenue pour un volume versé VE = 9,5 mL de la solution de permanganate de potassium. Comment cette équivalence est-elle repérée ?
2.3. À partir de ce titrage, le jardinier détermine le nom du produit commercial mis à sa disposition. Expliquer sa démarche, détailler ses calculs et donner le nom du produit commercial.
2.4. Pour estimer l'incertitude sur la valeur de la concentration obtenue par cette méthode de titrage, l'expérimentateur est amené à reproduire un grand nombre de fois la même manipulation dans les mêmes conditions.
Un des titrages réalisés donne une valeur de concentration très élevée en ions Fe2+ par rapport aux autres. Il est possible d'identifier deux erreurs de manipulations :
- La solution titrante de permanganate de potassium a été diluée par mégarde ;
- Le volume de solution à doser a été prélevé en trop faible quantité.
2.4.1. Indiquer dans quel sens chacune de ces deux erreurs de manipulation modifie la valeur expérimentale du volume VE de solution titrante versée à l'équivalence. Justifier chaque réponse.
2.4.2. Si l'on admet qu'une seule erreur de manipulation est la cause de la valeur très élevée de la concentration en ions Fe2+, laquelle a été commise ? Justifier votre réponse.
Exercice 5 : Le smartphone et la chimie
Les 4 parties de cet exercice sont indépendantes.
Le but de cet exercice est de découvrir différentes utilisations possibles d’un smartphone en sciences physiques.
1. Étude de la constitution de l’écran
Indications du fabriquant sur le smartphone utilisé :
Dimensions de l’écran : 5,98 cm × 10,62 cm
Résolution de l’écran : 720 px* × 1280 px*, 306 ppp*
Connectivité : Wi-Fi – Bluetooth® 4.0
*px = pixel et ppp = pixel par pouce
Un pouce est égal à 2,54 cm
Les écrans de smartphones sont des écrans LCD constitués de pixels (px) très petits. Ces pixels sont eux-mêmes constitués de 3 « sous-pixels » : un vert, un bleu et un rouge. En réflexion, ils se comportent avec la lumière comme un réseau optique à deux dimensions.
Description de l’expérience
Pour vérifier les indications du constructeur concernant la résolution de l’écran, on réalise l’expérience schématisée ci-dessous. Le laser émet un faisceau monochromatique de longueur d’onde l = 650 nm.
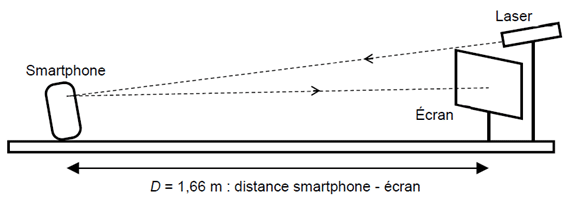
La figure obtenue dépend de la forme des pixels de l’écran.
Avec l’écran du smartphone utilisé ici, on observe une figure ressemblant au schéma ci-contre sur laquelle on peut repérer un paramètre noté i.
On peut relier ce paramètre i à la distance p séparant 2 pixels de l'écran du smartphone par la relation :
\[ i = \frac { \lambda \times D } { p } \]
Où : λ est la longueur d’onde du faisceau laser utilisé.

1.1 On parle généralement de dualité onde-particule au sujet de la lumière. Quel comportement de la lumière est mis en jeu lors de l’expérience présentée dans cette partie ?
1.2 À l’aide des résultats de l’expérience, déterminer la distance séparant deux pixels de l’écran du smartphone.
1.3 Vérifier que ce résultat est cohérent avec les indications du fabriquant. On considérera que les pixels sont accolés.
- Étude de la transmission Bluetooth®
Lors d’une autre séance de travaux pratiques, un élève utilise le smartphone pour filmer les oscillations d’un pendule simple de masse m = 100 g et de longueur notée L.
Pour réaliser cette vidéo, il utilise les réglages suivants sur la webcam du smartphone :
- Résolution 720 × 480 pixels ;
- Durée : 20 s ;
- 30 images par seconde ;
- Son désactivé ;
- Couleur 24 bits par pixels.
Données dans les unités du système international (u.s.i.) :
- Célérité des ondes électromagnétiques : c = 3,0×108 u.s.i. ;
- Intensité du champ de pesanteur terrestre : g = 9,81 u.s.i. ;
- 1 Mo = 106 octets et que 1octet = 8 bits.
Le Bluetooth®
Il s’agit d’une technologie de transfert de données sans fil.
Le Bluetooth® et certaines normes de Wi-Fi partagent la même bande de fréquence de 2,4 GHz mais ils n’ont pas du tout les mêmes usages. Le Wi-Fi est utile pour transmettre des données de taille importante avec une bande passante élevée. Au contraire, le Bluetooth® possède une bande passante plus faible et sert plutôt à transmettre des données de taille plus faible.
La norme Bluetooth® 4.0 permet un transfert avec un débit de 24 Mbit.s–1.
2.1 Quelle devrait-être en mégaoctets (Mo) la taille de la vidéo obtenue ?
L'élève transfère le fichier vidéo sur un ordinateur par Bluetooth® 4.0.
2.2 À quel domaine du spectre électromagnétique appartiennent les ondes émises par le smartphone lors du transfert Bluetooth® ? Justifier par un calcul.
2.3 Après compression la taille du fichier n’est plus que de 9,1 Mo. Déterminer la durée minimale de transfert de cette vidéo.
3. Utilisation de la vidéo pour l’étude des oscillations du pendule
3.1 En effectuant une analyse dimensionnelle, choisir parmi les trois relations ci-après celle qui permet de calculer la période T des petites oscillations de ce pendule.
a. \[ T = 2 \pi \sqrt{ \frac { m } { g } }\]
b. \[ T = 2 \pi \sqrt{ \frac { L } { g } }\]
c. \[ T = 2 \pi \sqrt{ \frac { g } { L } }\]
3.2 En visionnant la vidéo image par image, l’élève observe que le pendule passe par la position d’équilibre sur l’image n°16, puis il effectue une oscillation complète et repasse par la position d’équilibre sur l’image n° 50.
L’élève ayant oublié de mettre un repère de longueur lors de la capture de la vidéo, retrouver la longueur L du fil.
4. Dosage d’une solution colorée
Lors d’une troisième séance de travaux pratiques, les élèves doivent déterminer la concentration en permanganate de potassium dans une solution d’antiseptique (désinfectant qui empêche le développement de bactéries, champignons et virus).
Données :
- Masse molaire du permanganate de potassium KMnO4 = 158,0 g.mol-1 ;
- Une solution aqueuse de permanganate de potassium a une couleur rose / violette ;
- Spectre d’absorption d’une solution de permanganate de potassium ci-dessous.
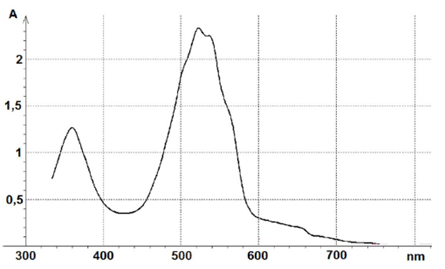
À partir d’une solution mère (solution n°1) de permanganate de potassium de concentration C1 = 2,5×10–4 mol.L–1, les élèves réalisent 3 solutions filles (n°2, 3 et 4) dont les concentrations molaires sont données dans le tableau ci-après.
Une fois l’échelle de teintes réalisée, les élèves la placent sur un fond blanc pour faire une photographie avec le smartphone. Ils obtiennent une image dans laquelle chaque pixel est codé sur 24 bits, c’est-à-dire 3 octets : un octet pour le rouge (R), un pour le vert (V) et un pour le bleu (B).
À l’aide d’une application, on obtient les 3 valeurs de code RVB (rouge, vert, bleu) des sous-pixels de l’image pour chacune des 5 solutions.

Par analogie avec l’absorbance mesurée par un spectrophotomètre, on calcule une grandeur.
| Solution | N° 1 | N° 2 | N° 3 | N° 4 | Antiseptique |
|---|---|---|---|---|---|
| C (mol.L-1 | C1= 2,5 x 10 -4 | C2= 1,0 x 10 -4 | C3= 5,0 x 10 -5 | C1= 1,5 x 10 -5 | CA = ? |
| [R,V,B] au-dessus de la solution | [190,181,176] | [202,194,183] | [207,201,187] | [208,200,189] | [201,194,183] |
| [R,V,B] dans la solution | [199, 68,136] | [210,134,162] | [212,169,178] | [212,189,184] | [206,172,179] |
| Aoctet | 0,43 | 0,16 | 0,075 | 0,025 | ? |
4.1 Nommer la verrerie nécessaire pour réaliser la solution n°3 à partir de la solution mère (solution n°1) et décrire précisément le protocole mis en œuvre.
4.2 Expliquer pourquoi la valeur de chaque sous-pixel est comprise entre 0 et 255.
4.3 Pourquoi, dans cette étude choisit-on la valeur du sous-pixel vert pour le calcul de la grandeur Aoctet plutôt que celle du rouge ou du bleu ?
Il y a quelques années, le fabricant de l’antiseptique indiquait dans la notice une teneur en permanganate de potassium de 1 mg pour 100 mL de solution. Cette indication n’apparaît plus sur le flacon neuf utilisé pour cette expérience.
4.4 Le fabricant a-t-il changé la teneur en permanganate de potassium de son antiseptique ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.





















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
merci pour ce questionnaire, il m’a beaucoup aidé. Mais peux-tu me faire passer les corrections ?