Chapitres

Organisation de la matière et de l'atome
Constitution de la matière
Que ce soit la matière vivante ou la matière inerte, tout ce qui est matériel est constitué d’atomes. Les molécules qui composent la matière sont elles-mêmes composées d’atomes.
L’atome est l’élément de base de la matière.
Par exemple, une molécule de dioxyde de carbone (CO2) est constituée d’un atome de carbone et de deux atomes d’oxygène. 
Constitution de l’atome
Un atome est composé du noyau d’une part, et du nuage électronique (l’ensemble des électrons) d’autre part. Les électrons se déplacent autour du noyau. Entre le noyau et les électrons, il y a du vide, beaucoup de vide ! C’est pour cela qu’on dit que la matière est lacunaire. Ce modèle d’atome date de 1932 avec la découverte du neutron qui s’est ajouté aux connaissances apportées en 1911 par Ernest Rutherford. 
Constitution du noyau de l’atome
Le noyau de l’atome, aussi appelé noyau atomique a la forme d’une sphère. Il est uniquement composé de protons et de neutrons. Ces éléments ont été définis comme étant des particules élémentaires, ce qui signifie qu’on ne savait pas de quoi elles se composaient. Note : En réalité, on sait aujourd’hui que ces particules élémentaires sont composées de quarks par exemple.
Les protons et les neutrons sont des nucléons.
Ainsi, lorsqu’on parle de nucléon, il peut s’agir de protons, ou de neutrons, ou des deux. En revanche, il ne faut pas confondre les protons avec les neutrons, qui désignent des particules élémentaires différentes. 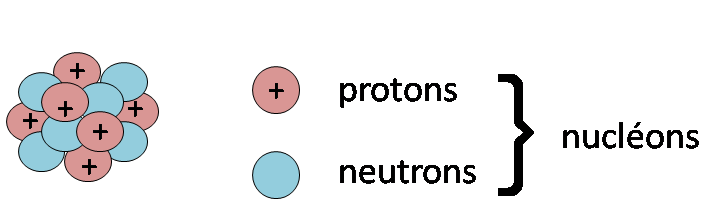
Liaison des protons et des neutrons : cohésion du noyau atomique
Les protons sont tous chargés positivement, ils devraient donc se repousser les uns les autres. Les protons restent en fait assemblés au sein du noyau avec les neutrons grâce à l’énergie nucléaire, aussi appelée force nucléaire. On dit aussi que la liaison nucléaire permet la cohésion du noyau de l’atome.
Plus couramment, on appelle la force nucléaire l’interaction forte.
Note : le terme nucléaire provient de nucleus qui signifie noyau.
Lien entre le noyau et les électrons : cohésion de l’atome
Cette fois-ci, c’est l’interaction électromagnétique entre le noyau et les électrons qui est responsable des mouvements des électrons autour du noyau d’un atome. Cette force agit sur tous les éléments qui ont une charge électrique. Cette force peut être répulsive entre deux éléments de charges identiques (positif et positif, ou négatif et négatif) ou attractive entre deux éléments de charges opposées (positif et négatif). On dit que l’interaction électromagnétique est responsable de la cohésion des atomes, c’est-à-dire de la cohésion entre le noyau et les électrons.
Caractéristiques de l'atome
Caractéristiques des composants de l’atome et de son noyau
Les protons sont chargés positivement, tandis que les électrons sont chargés négativement. Les neutrons sont électriquement neutres, comme leur nom l’indique.
| Particule élémentaire | Taille | Charge | Masse |
|---|---|---|---|
| Proton | 0,84 fm de rayon | e = +1,6.10-19 C | mp = 1,673.10-27 kg |
| Neutron | inconnu, de l'ordre du fm | e = 0 C | mp = 1,673.10-27 kg |
| Electron | inconnu, de l'ordre du fm | e = -1,6.10-19 C | mp = 9,110.10-31 kg |
- q p = + e
- q e- = - e
- q neutron = 0
Neutralité de l’atome et charges électriques de ses constituants
Les particules élémentaires peuvent être chargées positivement, chargées négativement, ou être électriquement neutres.
Or, un atome est toujours électriquement neutre.
Pourtant, les protons sont chargés positivement, alors que les électrons sont chargés négativement. Ces charges s’équilibrent pour que l’atome soit neutre : il y a donc autant de charges positives que de charges négatives, autrement dit il y a autant de protons que d’électrons.
- Exemple 1 : Un atome d’hydrogène a un noyau composé d’un proton uniquement (il n’y a pas de neutron), il n’y a donc qu’un seul électron.
- Exemple 2 : Un atome de carbone a un noyau composé de 6 protons et de 6 neutrons. Pour équilibrer les 6 protons chargés positivement, il y a donc 6 électrons chargés négativement.
Représentation et composition de l'atome
Représentation symbolique du noyau atomique avec AZX
Afin de représenter le noyau et l’atome de façon symbolique, on peut utiliser le symbole chimique noté X. Le symbole chimique d’un atome correspond à une ou deux lettres issues du nom entier de l’élément représenté. Ce X peut correspondre par exemple :
- à H pour l’hydrogène ;
- à C pour le carbone ;
- à Fe pour le fer ;
- à Mg pour le magnésium ;
- etc.
Note : S’il y a deux lettres, la première est toujours en majuscule, et la seconde en minuscule. A correspond au nombre total de nucléons, c’est-à-dire aux protons et aux neutrons additionnés. On parle aussi du nombre de masses. Enfin, Z correspond au numéro atomique. Il correspond également au nombre de protons. 
Nombre de nucléons, de neutrons, de protons et d’électrons d’un atome
A partir du modèle AZX présenté ci-dessus, on peut déterminer le nombre de nucléons, de neutrons, de protons et d’électrons d’un atome donné. Z correspond au nombre de protons, et donc également au nombre d’électrons puisqu’il doit y avoir autant de protons (charges positives) que d’électrons (charges négatives) dans un atome afin qu’il soit électriquement neutre. Le nombre de neutrons, noté N, peut être déduit en calculant la différence entre le nombre de nucléons et le numéro atomique (= nombre de protons) : N = A - Z. On peut ainsi retenir que :
- le nombre de protons = numéro atomique = Z
- le nombre d’électrons = nombre de protons donc = numéro atomique = Z
- le nombre de nucléons = A – Z
Exemple : pour un atome de carbone classique 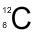
- A = 12 nucléons = 12 masses ;
- Z = 6 protons.
Un atome étant toujours électriquement neutre, il doit avoir autant d’électrons que de protons, on en déduit ainsi que l’atome de carbone a 6 électrons. Enfin, il y a A-Z neutrons, c’est-à-dire 6 neutrons en l’occurrence. Note : Les atomes contiennent souvent un nombre de neutrons proche du nombre de neutrons, voire égal, afin d’avoir une structure stable, mais il faut faire attention car ça n’est pas toujours le cas. Exemple : Le noyau de l’uranium est composé de 92 protons (et donc d’autant d’électrons) et de 138 neutrons.
Numéro atomique et classification périodique de Mendeleïev
La classification périodique, également appelée tableau périodique ou encore tableau de Mendeleïev, est un tableau qui rassemble tous les éléments chimiques présents dans la nature que nous connaissons à l’heure actuelle.
Ce tableau classe tous ces éléments par ordre croissant de numéro atomique.

Les isotopes
Chaque type d’atome est caractérisé par son nombre de protons qui lui est propre. Par exemple, tous les atomes de carbone contiennent 6 protons dans leur noyau. Ainsi, un atome contenant 6 protons est nécessairement un atome de carbone. Au contraire, un atome contenant un nombre différent de protons ne peut pas être un atome de carbone. En revanche, il peut y avoir des atomes avec le même nombre de protons mais avec des nombres de neutrons différents : on dit que ce sont des isotopes. Tous les isotopes du carbone ont donc 6 protons, mais ils peuvent avoir 6 neutrons, ou 7, ou 8 par exemple. Ainsi, pour un élément chimique donné, plusieurs isotopes peuvent être associés.
Des isotopes ont les mêmes propriétés chimiques mais leur stabilité peut être différente.
Résumer avec l'IA :





















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
bonjour Professeur
comment sont composées les atomes du vivant : nombre électrons, protons, neutrons.
Bonjour,
Il y a bien une petite coquille ici :
On peut ainsi retenir que :
le nombre de protons = numéro atomique = Z
le nombre d’électrons = nombre de protons donc = numéro atomique = Z
» le nombre de nucléons = A – Z »
Très bon cours par ailleurs!
Pourquoi la masse molaire d’un ion est elle l’a même que celle de l’atome dont ils provient ?
Est ce qu’un noyau peut être constitué seulement de neutrons?
Je dirais que non puisque sans proton pas d’électron et donc pas d’électromagnétisme pour une cohésion avec rien puisque c’est une particule libre, pour former un atome il va se désintégrer en un proton, un neutron et un antineutrino ce qu’il se passe après c’est trop compliqué pour moi…
Remarque : pour l’uranium, 92 protons et 138 neutrons donnent un total de 230 nucléons, alors que le tableau de classification indique 238.
A 80 ans, je mets à jour mes notions de physique du lycée… qui en avaient bien besoin. Je trouve cet article remarquable par sa clarté.