Chapitres
- 01. Les ions
- 02. Le principe des tests de reconnaissance d'ions
- 03. Réalisation pratique d'un test de précipitation
- 04. Quelques inconvénients des tests de précipitation
- 05. Les principaux tests de reconnaissance d'ions
- 06. Tableau récapitulatif des expériences
- 07. Rédiger le compte-rendu de fin de TP
D'une manière générale, un test de reconnaissance est utilisé pour confirmer ou infirmer la présence d'une espèce chimique dans un milieu (gaz, solution, etc).
Il permet par exemple de vérifier la formation d'une espèce chimique lors d'une réaction chimique ou bien d'analyser la composition d'une solution inconnue.

Les ions
Définition
Un ion est une espèce chimique monoatomique ou polyatomique électriquement chargée.
Un ion se forme à partir d'une espèce chimique qui suite à un phénomène chimique (réaction) ou un phénomène physique (frottement mécanique, rayonnement) perd ou gagne un ou plusieurs électrons.
Autre formulation
Un ion est un atome, qui à perdu ou gagné un ou plusieurs électrons (3 max.). Exemple, le lithium (Li) perd un électron il devient l'ion de lithium (Li+). Un autre exemple, le fluor (F) gagne un électron, il devient l'ion de fluor (F-). Si un atome perd 2 électrons, imaginons que cette atome soit l'hydrogène (H), il devient l'ion d'hydrogène (H+2).
- Un atome (ou groupe d'atomes) qui perd un ou plusieurs électrons devient une espèce chimiquement chargée appelée ion. La charge du noyau reste inchangée.
- Un ion négatif est un atome (ou groupe d'atome) qui à gagné un ou plusieurs électrons.
- Un ion positif est un atome (ou groupe d'atome) qui à perdu un ou plusieurs électrons.
L'électron est donc l'un des composants de l'atome au même titre que les neutrons et protons. C'est une particule élémentaire que l'on note petit e et dont la charge élémentaire est de signe négatif. Ils s'organisent autour du noyau de l'atome dans ce que l'on appelle un nuage électronique.
Les électrons et leurs propriétés ont aidé à la compréhension d'une multitude de phénomènes physiques, notamment en termes de conductivité.
On distingue sorte d'ions :
- Les ions positifs appelés cations qui se forment en perdant des électrons
Exemples: H+, Cu2+, NH4+ - Les ions négatifs appelés anions qui se forment en gagnant des électrons
Exemples: OH-, S2-, HCOO-
Neutralité électrique de la matière

A l'échelle macroscopique (échelle humaine) la matière liquide ou solide est toujours électriquement neutre ce qui implique qu'une matière ionique est toujours composée de cations et d'anions qui composent leur charge électriques. Cette neutralité permet de prévoir la proportion des cations et des anions.
Exemple :
- Du chlorure de sodium contient autant d'ions chlorure ( Cl- ) que d'ions sodium ( Na+ ) car chacun ne porte qu'une seule charge.
- Du chlorure d'aluminium comporte trois fois plus d'ions chlorure ( Cl- ) que d'ions aluminium ( Al3+ ) car il faut réunir trois ions chlorure pour compenser la charge portée par un ion aluminium.
Structure électronique des ions monoatomiques
Etant donné qu'un ions se forme en perdant ou en gagnant des électrons sa structure électronique est différente de celle de l'atome de départ mais Il est possible de la déduire de la formule de l'ion :
- La formule de l'ion indique comment il s'est formé. Par exemple un exposant 2+ indique qu'il y a eu perte de deux électrons, un exposant - indique qu'il y a eu gain d'un électron.
- Il faut reprendre la structure électronique de l'atome initiale et ajouter ou retirer les électrons gagnés ou perdu de la dernière couche.
Exemple : structure électronique de l'ion Al3+
La formule Al3+ indique que l'ion aluminium s'est formé en perdant 3 électrons
La structure électronique de l'atome d'aluminium de numéro atomique 13 est ( K )2( L )8( M )3.
Si l'on retire 3 électrons de la dernière couche alors la couche M qui comportait initialement 3 électrons devient vide et il n'est plus nécessaire de l'écrire.
La configuration électronique de l'atome d'aluminium est donc ( K )2( L )8 .
Le cristal ionique
Les cristaux ioniques sont constitués d'anions et de cations tenus entre eux par l'attraction électrique. Cette attraction est responsable de la structure géométrique qu'adoptent les ions pour former un cristal. Un ion positif va s'entourer d'ions négatifs et réciproquement et de la même manière que les atomes ou molécules forment les solides, les ions forment les cristaux.

Exemple
Dans un cristal de chlorure de sodium NaCl, les ions adoptent une structure cubique où un anion est entouré de 6 cations. Un cristal ionique est toujours électriquement neutre donc il y a autant de charges positives que négatives. Par conséquent, certains cristaux possèdent plus d'anions et de cations (ou inversement).
Cohésion des cristaux ioniques
Les ions étant jointifs, la distance qui les sépare correspond à la distance entre leur centre.
La cohésion du cristal est due à l'interaction coulombienne qui correspond à la force qui lie deux ions. La valeur de cette force peut paraître faible mais elle est bien plus importante par rapport au poids de l'ion. A cette échelle, c'est la force électrique qui domine. La température de fusion des solides ioniques est assez élevée (801 °C) pour le sel, ce qui veut dire que les liaisons entre ions sont très solides.
La loi de Coulomb
Coulomb, un physicien français, a établi en 1758 que le champ doit varier comme le carré inverse de la distance entre les charges à une précision de 0,02 sur l'exposant avec l'aide d'un dispositif appelé balance de Coulomb. Cette balance est constituée d'un fil de torsion en argent sur lequel est fixé des matériaux chargés. Ainsi, la loi d'attraction entre deux charges ponctuelles notées q1 et q2 , fixes dans le référentiel défini et séparées par une distance r, se définit ainsi :
- La force est dirigée selon la droite reliant les deux charges ;
- Elle est attractive si les charges sont de signes opposée et répulsive sinon ;
- Son intensité est proportionnelle aux valeurs de q1 et q2 et varie en raison inverse du carré de la distance r.
Il est alors possible de traduire ces caractéristiques en une formule exprimant la force exercée par q1 sur q2 :

Avec :
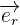 le vecteur unitaire de la droite reliant q1 et q2 qui est dirigée dans le sens 1 vers 2
le vecteur unitaire de la droite reliant q1 et q2 qui est dirigée dans le sens 1 vers 2 la permittivité diélectrique du vide
la permittivité diélectrique du vide
Ce qui peut rendre la compréhension de cette formule compliquée est la notion de force à distance. En effet, comment une charge peut savoir qu'une autre charge ponctuelle se trouve à une certaine distance d'elle et alors exercer sur force sur cette charge en fonction de la distance qui les sépare.
Dans ce cas, tout comme pour un champ gravitationnel, il peut être utile de séparer dans la loi de force ce qui dépend de la charge subissant la force et donc d'obtenir la relation suivante :
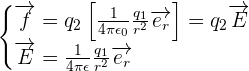
Avec :
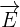 un champ électrique électrostatique créé à partie de la charge q1 au point où se trouve la seconde charge q2
un champ électrique électrostatique créé à partie de la charge q1 au point où se trouve la seconde charge q2
Ainsi, avec cette relation, il est plus aisé d'interpréter l’existence d'une force à distance. En effet, la charge considérée comme "source", c'est-à-dire q1, crée en tout point de l'espace un champ électrique dont la forme est donnée par la relation exprimée ci-dessus, et une charge quelconque considérée comme "test" subira l'effet de ce champ sous la forme d'une force égale au produit de cette charge par le champ électrostatique. Dans ce cas, ce champ électrostatique apparaîtra comme la force entre deux particules ponctuelles fixes par unité de charge.
Le principe des tests de reconnaissance d'ions

Les tests de reconnaissance d'ions sont en général construits sur la base de réactions chimiques de "précipitation".
Les réactions de précipitation sont des réactions qui conduisent à la formation, en solution, de solides à consistance gélatineuse, de couleurs variables, facilement repérables et que l'on appelle "précipités".
Lorsque l'on recherche un ion, il va falloir provoquer une précipitation à partir de cet ion, c'est à dire choisir avec soin un réactif contenant un ion qui formera un solide (= un précipité) de faible solubilité avec l'ion qui est recherché.
Réalisation pratique d'un test de précipitation
Dans la pratique, les différentes étapes à suivre sont les suivantes :
Etape 1 : il s'agit de commencer par prélever dans un tube à essai un échantillon (quelques millilitres suffisent) de la solution à analyser.
Etape 2 : puis on ajoute à cette solution à analyser quelques gouttes du réactif associé au test, et qui doit normalement réagir avec les ions recherchés.
Remarque : comme on le verra par la suite, ce réactif est souvent de la soude pour les tests de reconnaissance les plus simples.
Etape 3 : pour finir on observe le résultat et on vérifie qu'il se forme un précipité et que ce dernier possède bien la couleur prévue
Si aucun changement n'est visible, deux solutions sont envisageables :
- il est possible d'augmenter la quantité de réactif (ajouter quelques gouttes supplémentaires)
- ou bien il faut peut être attendre quelques instants car il arrive que la formation de certains précipités soit lente.
Quelques inconvénients des tests de précipitation
La précipitation ne peut se faire que si la limite de solubilité du précipité est atteinte ce qui risque de n'être pas le cas si la solution analysée est très peu concentrée.
Ainsi, si aucun précipité ne se forme lors d'un test, on ne peut donc conclure formellement à l'absence d'un ion. En effet, il est également possible que cet ion soit présent mais en concentration très faible.
A contrario, lorsque le réactif est ajouté en proportion trop importante, il peut provoquer une redissolution immédiate du précipité formé. C'est en particulier le cas lorsqu'on ajoute trop de soude pour tester la présence des ions Aluminium ou des ions Zinc.
Les principaux tests de reconnaissance d'ions
Etudions maintenant un peu plus en détail les principaux tests de reconnaissance d'ions.
Test de reconnaissance des ions Cuivre II
Lorsque l'on met des ions Cuivre (II) Cu2+en présence d'une solution de Soude, un précipité bleu doit se former.
L'expérience consiste par exemple à prélever une solution de Sulfate de Cuivre (II), et à la mettre en présence de Soude.
Elle mène alors à la formation d'un précipité d'Hydroxyde de Cuivre (Cu(OH)2).
Les illustrations ci-dessous résument l'expérience réalisée :


La réaction de précipitation qui a eu lieu est la suivante :
Ions cuivre II + ions hydroxyde → précipité d'hydroxyde de cuivre
Elle se traduit par l'équation de réaction chimique suivante :
Cu 2+ + 2 OH - → Cu(OH) 2
Test de reconnaissance des ions Fer II
Le test de reconnaissance des ions Fer II est assez similaire au test de reconnaissance des ions Cuivre II.
En effet, lorsque l'on met des ions Fer (II) Fe2+en présence d'une solution de Soude, un précipité verdâtre doit se former.
L'expérience consiste par exemple à prélever une solution de Sulfate de Fer (II), et à la mettre en présence de Soude. Elle mène alors à la formation d'un précipité d'Hydroxyde de Fer (Fe(OH)2).
Les illustrations ci-dessous résument l'expérience réalisée :


La réaction de précipitation qui a eu lieu est la suivante :
Ions fer II + ions hydroxyde → précipité d'hydroxyde de fer II
Elle se traduit par l'équation de réaction chimique suivante :
Fe2+ + 2 OH- → Fe(OH)2
Test de reconnaissance des ions Fer III
Lorsque l'on met des ions Fer (III) Fe3+ en présence d'une solution de Soude, un précipité de couleur jaune-orange doit se former.
L'expérience consiste par exemple à prélever une solution de Sulfate de Fer (III), et à la mettre en présence de Soude. Elle mène alors à la formation d'un précipité d'Hydroxyde de Fer (Fe(OH)3).
Les illustrations ci-dessous résument l'expérience réalisée :


La réaction de précipitation qui a eu lieu est la suivante :
Ions fer III + ions hydroxyde → précipité d'hydroxyde de fer III
Elle se traduit par l'équation de réaction chimique suivante :
Fe3+ + 3 OH- → Fe(OH)3
Test de reconnaissance des ions Zinc II
Le test de reconnaissance des ions Zinc II est assez similaire au test de reconnaissance des ions Cuivre II et des ions Fer II.
En effet, lorsque l'on met des ions Zinc (II) Zn2+en présence d'une solution de Soude, un précipité blanc doit se former.
L'expérience consiste par exemple à prélever une solution de Chlorure de Zinc (II), et à la mettre en présence de Soude. Elle mène alors à la formation d'un précipité d'Hydroxyde de Zinc (Zn(OH)2).
Les illustrations ci-dessous résument l'expérience réalisée :


La réaction de précipitation qui a eu lieu est la suivante :
Ions zinc II + ions hydroxyde → précipité d'hydroxyde de zinc II
Elle se traduit par l'équation de réaction chimique suivante :
Zn2+ + 2 OH- → Zn(OH)2
Test de reconnaissance des ions Chlorure
Lorsque l'on met des ions Chlorure Cl- en présence d'une solution de Nitrate d'Argent, un précipité blanc doit se former.
Les illustrations ci-dessous résument l'expérience réalisée :


La réaction de précipitation qui a eu lieu est la suivante :
Ions chlorure + ions argent → précipité de chlorure d'argent
Elle se traduit par l'équation de réaction chimique suivante :
Ag+ + Cl- → AgCl
Tableau récapitulatif des expériences
| Formule chimique de l'ion à reconnaitre | Couleur de la solution aqueuse | Réactif | Couleur du précipité |
|---|---|---|---|
| Cu2+ | Bleue | Soude (hydroxyde de sodium) Na+ + OH- | Bleu |
| Fe2+ | Vert parfois imperceptible | Soude (hydroxyde de sodium) Na+ + OH- | Vert foncé |
| Fe3+ | Jaune | Soude (hydroxyde de sodium) Na+ + OH- | Jaune - orange |
| Zn2+ | Incolore | Soude (hydroxyde de sodium) Na+ + OH- | Blanc |
| Cl- | Incolore | Nitrate d'argent NO3- + Ag+ | Blanc qui noircit à la lumière |
Rédiger le compte-rendu de fin de TP

Les conseils énoncés ci-dessous sont généralistes et peuvent être utilisés dans le cadre de n'importe quel TP.
Comprendre l'énoncé du TP
Le plus important avant de commencer votre TP est de lire une ou plusieurs fois l'énoncé afin de le comprendre. Au besoin, ressortez vos cours et revoyez les notions que vous allez avoir à travailler pour être au point. Si vous considérez qu'il vous manque d'importantes informations pour commencer, demandez de l'aide à vos camarades ou vos professeurs.
Élaborer un protocole afin de travailler efficacement
La deuxième étape de votre travail est de commencer à réfléchir au cheminement de votre TP. En effet, il faut que vous sachiez où vous voulez aller et ce que vous avez à démontrer pour commencer à envisager les moyens à utiliser. C'est ce que l'on appelle la rédaction de votre protocole expérimental. C'est votre plan de travail. Au brouillon, notez vos idées. Reprenez-les une par une et pensez à la façon dont vous comptez mettre en oeuvre et réaliser l'expérience.
- Cette expérience répond-t-elle à la question posée dans l'énoncé ? ;
- Suis-je en mesure d'effectuer cette expérience ? ;
- Ai-je les connaissances nécessaires pour interpréter les résultats de mon expérience ?
Une fois cette check-list validée, vous pouvez rédiger au propre votre protocole expérimental. Pour cela, écrivez proprement et lisiblement en utilisant des phrases courtes et des mots clairs. Inutile de vous noyer dans des explications trop poussées. Vous devez utiliser des verbes d'action qui traduisent uniquement les actes que vous allez réaliser durant votre expérience. En fin de rédaction du protocole expérimental, pensez à surtout mentionner les mesures de sécurité à prendre pour la réalisation de votre expérience. mentionnez les équipement de sécurité nécessaires : lunettes, gants, blouse, hotte aspirante, etc. Vous pouvez aussi agrémenter le protocole d'un schéma de l'expérience en détaillant de manière précise le matériel utilisé et en soignant votre dessin.
Énoncer ses hypothèses
Ecrivez les hypothèses que vous souhaitez démontrer à l'issue de votre expérience. Indiquez dans quels cas elles sont validées et dans quels cas elle sont réfutées.
Réaliser l'expérience demandée
Maintenant que le protocole et les hypothèses ont été posés et établis, vous pouvez vous mettre à la pratique. Utilisez bien les équipements de protection utiles à la réalisation de l'expérience. Procédez avec calme et rigueur. Suivez pas à pas les étapes du protocole expérimental. N'hésitez pas à prendre des notes pendant l'expérience, vous pourrez ainsi en rendre compte. Inscrivez vos problèmes rencontrés ou éventuellement les modifications que vous avez du apporter au protocole pour rendre l'expérience réalisable.
Rédiger le compte-rendu
Dans votre compte-rendu, vous devez rapporter le résultat de votre expérience tout en validant ou en réfutant votre ou vos hypothèses. Notez bien le déroulement de votre expérience et les conclusions que vous en avez tiré. Vous pouvez y ajouter des remarques sur la réalisation de l'expérience. On peut également ajouter des documents tels que des photographies de l'expérience ou encore des croquis et des graphiques.
Conclure le TP
Pour finir, vous devez rédiger une conclusion. Dans cette dernière, reprenez l'énoncé et apportez y une réponse, en vous servant de votre expérience pour la justifier. Soignez bien cette partie, c'est elle qui solde votre TP et votre note en dépend beaucoup.
Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour,
j’aimerai savoir quel réactif utilisé pour reconnaitre l’anhydrite (CaSo4) et le gypse (CaSO2,2H2O) ?
Merci pour la réponse
Bonjour j’aimerai savoir quel est le détecteur des ions sodium et de quel couleur est le précipité
Merci d’avance
Merci infiniment que dieu vous protège
J’ai besoin d’aide sur les exercices de la dureté et de des dosage avec le calcium et le magnésium
Ça ma beaucoup aider
J’ai besoin du test d’identification des ions calcium
Bonjour Mr j’ai besoin du test d’identification des ions
super clair, juste une petite faute de frappe « Lorsque l’on met des ions Chlorure Cl- en présence d’une solution de Nitrate d’Argent, un précipité bleu doit se former » il faut remplacer bleu par blanc comme c’est marquée dans le tableau en dessous
Bonjour,
Effectivement, il y avait une erreur. Merci à vous.
Bonne journée !