Chapitres
La molécule de Lewis est une représentation schématique utilisée en chimie pour illustrer la structure électronique des molécules. Elle aide à comprendre les liaisons chimiques et la géométrie moléculaire.
✏️ Chaque atome est représenté par son symbole et ses électrons de valence (ceux impliqués dans les liaisons) sont indiqués par des points ou des paires d'électrons
Les règles de l'octet et du duet guident la distribution des électrons pour stabiliser les atomes.
Cette approche permet de prédire les propriétés chimiques et physiques des composés, influençant ainsi les réactions chimiques et les applications pratiques dans la vie quotidienne et l'industrie.

Organisation des électrons au sein d’un atome ⚛️

Savez-vous de quoi se compose un atome ? C'est très simple :
- Le noyau d’un atome se compose de protons et de neutrons
- Les électrons gravitent autour de ce noyau atomique
- Les électrons se répartissent par couches autour du noyau, en allant de la couche la plus proche du noyau à la couche la plus éloignée
Les différentes couches électroniques
Selon le nombre d’électrons, il y a plus ou moins de couches d’un atome à l’autre. On parle de couches électroniques.
- La couche la plus proche est la couche K, elle peut accueillir jusqu’à 2 électrons
- Une fois la couche K remplie, et s’il y a plus de 2 électrons dans l’atome, la couche L accueille les autres électrons. La couche L peut accueillir jusqu’à 8 électrons
- Une fois la couche L pleine, la couche M accueille les électrons restants. Elle peut accueillir jusqu’à 18 électrons, et ainsi de suite.

C’est l’atome de carbone qui est ici représenté :
- Il n’a que 6 électrons
- Il a donc la couche K qui est remplie par 2 électrons
- 6 – 2 = 4, il reste donc 4 électrons à positionner
- Ces 4 électrons vont sur la couche suivante vers l’extérieur : la couche L
- La couche L n’est pas remplie mais tous les électrons sont positionnés
- La couche M va donc rester vide
Au lycée, on n'aborde en général les couches K, L et M uniquement. Mais il en existe d’autres. En voici quelques-unes avec le nombre maximal d’électrons que chaque couche électronique peut accueillir :(K)2 (L)8 (M)18 (N)32 (O)50 (P)72
Note : Attention à ne pas confondre les couches avec les sous-couches s, p, d et f. La notion de sous-couches n’est pas au programme du lycée.
La couche électronique externe
Les électrons d’un atome s’organisent par couches autour du noyau. Seule la couche externe (la plus à l’extérieur, la plus loin du noyau) nous intéressera ici.
? C’est en fait la seule couche qui permet à un atome de se lier à d’autres atomes, par le biais des électrons de la couche externe. Cette couche est appelée « couche de valence ».
D’un atome à l’autre, ça n’est pas la même couche (K, ou L , ou M, etc.).
De la même façon, le nombre d’électrons de valence d’un atome correspond au nombre d’électrons positionnés sur la couche la plus éloignée du noyau.
Couche de valence et nombre de liaisons ?
Nombre d’électrons sur la couche de valence
Afin de déterminer le nombre de liaisons que va former l’atome, il faut déterminer le nombre d’électrons qu’il y a sur la couche de valence (la plus externe).
En effet, deux atomes se lient entre eux en mettant en commun les électrons de leurs couches de valence.
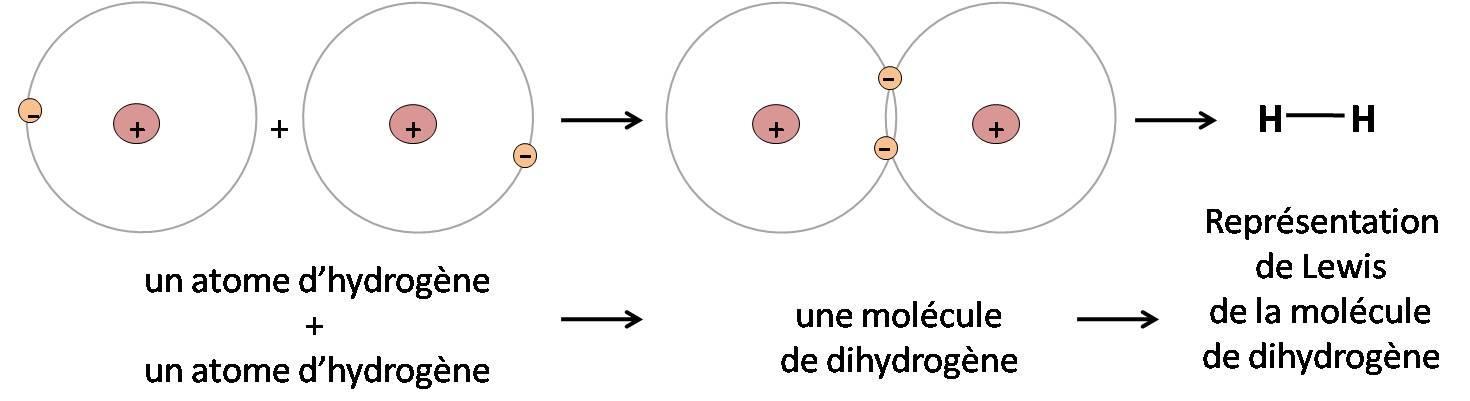
⚠️ L’hydrogène n’a qu’un seul électron sur sa couche de valence K. Il partage cet électron avec un autre atome (ici un autre atome d’hydrogène) afin de devenir une molécule stable
Pour le carbone par exemple, on sait qu’il y a 6 protons (chargés positivement), il y a donc 6 électrons (chargés négativement) pour que l’atome soit neutre. Nous avons vu ci-dessus que la couche K est remplie par 2 électrons, et la couche L par 4 électrons seulement dans le cas du carbone.
Il y a donc 4 électrons sur la couche de valence pour le carbone.
La liaison covalente
〰️ Afin de former des molécules, plusieurs atomes sont liés par des liaisons covalentes. Cette liaison consiste en un partage d’électrons entre deux atomes :
- Une liaison covalente est représentée par un trait. On parle également de doublet liant
- Il peut également y avoir des liaisons doubles entre deux atomes, représentées par deux traits
- La dernière possibilité est d’avoir des liaisons triples, représentées par trois traits. On parle de liaisons covalentes multiples. Les liaisons triples sont les plus stables car il est logiquement plus difficile de casser trois liaisons qu’une seule ou même deux
En parallèle, certains électrons dits libres ne sont engagés dans aucune liaison. On les appelle aussi électrons célibataires. Lorsque deux électrons célibataires sont appariés (forment une paire), on parle de doublet non liant.

Rappel : Seuls les électrons de la couche électronique la plus externe peuvent former des liaisons. Les électrons des couches plus internes ne peuvent pas s’engager dans des liaisons, on les appelle les électrons de cœur, en opposition aux électrons de valence.
Règle de l’octet et du duet
C'est une règle incontournable pour la molécule de Lewis :
« Toute transformation chimique d’un élément tend à lui permettre d’acquérir la structure électronique stable en duet ou en octet du gaz rare dont il est le plus proche dans le tableau périodique »
Larousse
Plus précisément, selon signifie que chaque atome cherche à remplir sa couche électronique la plus externe en empruntant des électrons à d’autres atomes afin d’être stable.
Explication de la règle de l’octet
Cela signifie qu’un atome cherche à disposer de 8 électrons sur sa couche électronique M pour être le plus stable possible. Ainsi, un atome ne disposant que de 4 électrons sur sa couche M, comme c’est le cas du carbone, va chercher à se lier à un autre atome pour lui « emprunter » ou plutôt partager 4 autres électrons.
Explication de la règle du duet
Dans le cas d’un atome ayant 4 électrons ou moins, la couche K doit se stabiliser en se remplissant avec deux électrons seulement.
? La règle du duet ne concerne que l’hydrogène, l’hélium et le lithium en vue d’avoir une configuration proche de celle de l’hélium
On dit aussi que l’objectif des atomes est d’être le plus stable possible de façon à avoir une structure électronique externe la plus proche possible du gaz rare (ou gaz noble) le plus proche. Ces gaz sont dans la dernière colonne du tableau périodique de Mendeleïev.
Détermination du nombre de liaisons
- À partir du numéro atomique d’un atome, on connait le nombre d’électrons qu’il possède (numéro atomique = nombre de protons = nombre d’électrons).
- À partir de ce nombre d’électrons, on détermine le nombre d’électrons pour chaque couche électronique.
- On détermine ensuite le nombre d’électrons célibataires sur la couche de valence (la plus externe).
- Enfin, on détermine le nombre de liaisons possibles en soustrayant le nombre d’électrons célibataires au nombre maximal d’électrons que peut accueillir la couche de valence. Exemple de l’oxygène : 8 – 6 = 2 liaisons.
| Atome | Nombre d'électrons | Remplissage des couches électroniques | Nombre d'électrons de valence | Nombre de liaisons |
|---|---|---|---|---|
| Hydrogène | 1 | (K)1 | 1 | 1 |
| Carbone | 6 | (K)2 (L)4 | 4 | 4 |
| Azote | 7 | (K)2 (L)5 | 5 | 3 |
| Oxygène | 8 | (K)2 (L)6 | 6 | 2 |
| Fluor | 9 | (K)2 (L)7 | 7 | 1 |
| Sodium | 11 | (K)2 (L)8 (M)1 | 1 | 1 |
| Magnésium | 12 | (K)2 (L)8 (M)2 | 2 | 2 |
| Phosphore | 15 | (K)2 (L)8 (M)5 | 5 | 3 |
| Soufre | 16 | (K)2 (L)8 (M)6 | 6 | 2 |
| Chlore | 17 | (K)2 (L)8 (M)7 | 7 | 1 |
Les représentations et la molécule de Lewis
La structure de Lewis est une représentation schématique utilisée en chimie pour montrer les atomes et les électrons de valence (liaisons) d'une molécule.
Elle permet de comprendre les liaisons chimiques et la géométrie moléculaire.
D’une représentation à l’autre
On peut partir de la formule développée qui présente déjà toutes les liaisons covalentes, c’est-à-dire tous les doublets liants. En ajoutant les doublets non-liants pour chaque atome, la formule développée devient alors la molécule de Lewis.
Dans le modèle de Lewis, on représente chaque électron par un point, puis on relie les électrons deux par deux : ainsi il n’y a plus de points mais seulement des traits.
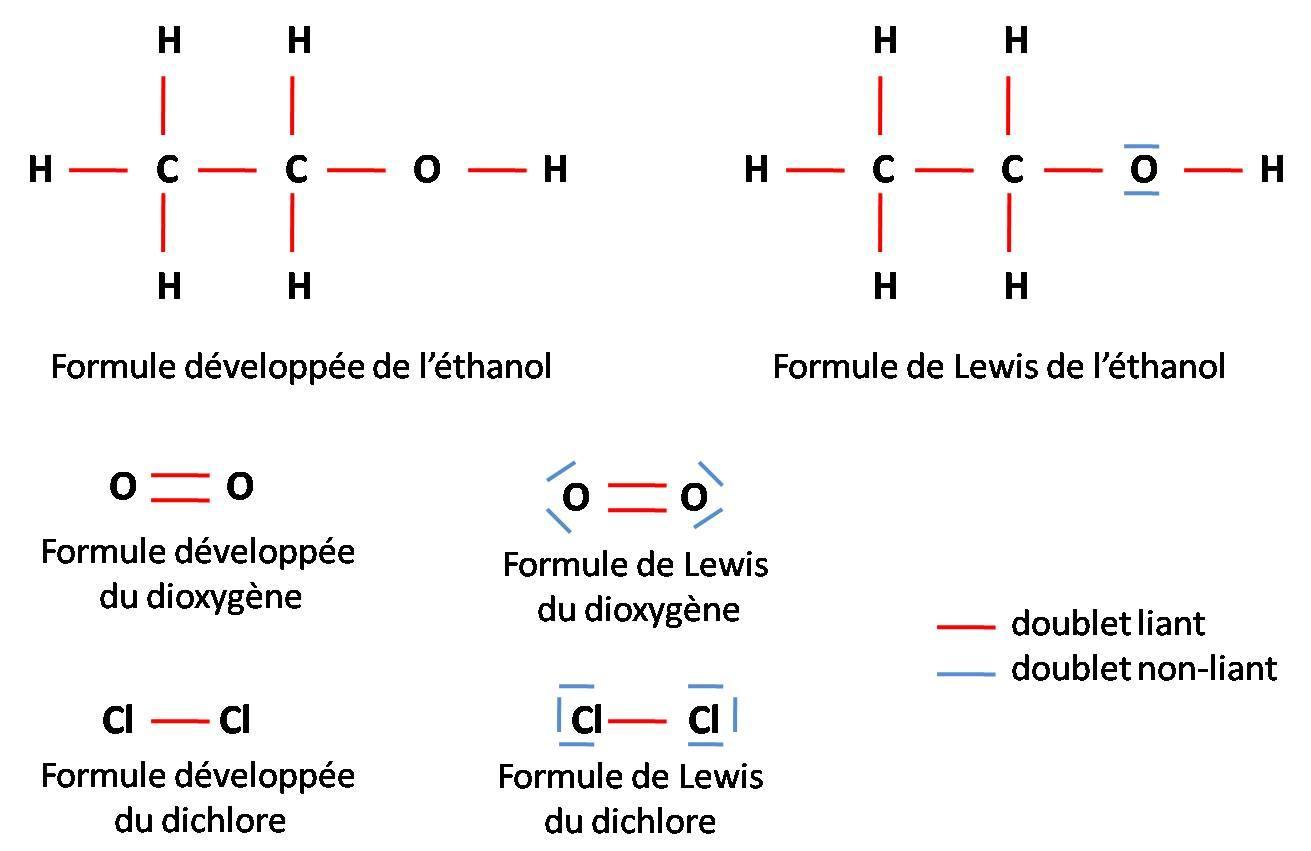
? La représentation de Lewis est aussi appelée formule de Lewis ou encore structure de Lewis. Toutes ces formulations correspondent à la même et unique chose
Intérêt de la représentation de Lewis
Contrairement à la formule semi-développée ou même développée, la formule de Lewis a l’avantage de permettre de prévoir la géométrie en trois dimensions d’une molécule :
Plane
Pyramidale
Tétraédique
En effet, tous les doublets sont représentés, qu’ils soient liants ou non liants. Or, les électrons étant tous chargés négativement, ils se repoussent les uns les autres. Ainsi, sachant qu’ils se positionnent dans l’espace de façon à être le plus loin les uns des autres, il est facile d’imaginer la répartition des doublets.
Connaître la forme géométrique d’une molécule permet en outre de prédire sa réactivité pour ensuite prévoir les réactions chimiques potentielles.
Note : Lewis a proposé ce nouveau de représentation des molécules en 1916. Avant cela, il fallait se contenter des formules brutes et semi-développées qui ne présentaient pas les informations pour comprendre la réactivité chimique des molécules, ou bien il fallait utiliser des représentations beaucoup plus complexes.
Méthodes pour représenter une molécule selon Lewis
Méthode pour représenter une molécule avec la représentation de Lewis :
- Écrire la formule brute : ainsi on connaît tous les atomes de la molécule
- Donner la configuration électronique de chacun de ces atomes
- Déterminer le nombre d’électrons sur la couche externe pour chacun de ces atomes
- Définir les liaisons covalentes de chaque atome ainsi que les doublets non liants
- L’atome qui a le plus de liaisons covalentes (de doublets liants) est un atome central
- Disposer les autres atomes autour de l’atome central de façon à respecter la formule de la molécule et le nombre de liaisons covalentes de chaque atome
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Merci beaucoup !
Moi je la chimie arôme cosmétique phythomedicament et j’aimerais rejoindre votre groupe pour l’instant. Je me suis intéressé tous que vous avez partagé là.
Merci beaucoup. Mais j’ai une préoccupation : la méthode de la détermination de nombre de liaison n’est pas applicable pour les autres éléments si on soustrait le nombre d’électrons célibataire par le nombre d’électrons maximum. Prière de m’éclaircir là !
Bonjour ! Si vous recherchez un soutien personnalisé, nos professeurs sur Superprof sont à votre disposition pour vous aider à atteindre vos objectifs. Passez une excellente journée !
J’aime ce cour mais comment fais je pour m’abonner
Bonjour, je vous invite à rencontrer nos professeurs sur Superprof pour bénéficier d’un accompagnement personnalisé. Vous pouvez vous inscrire directement sur le site de Superprof en faisant une recherche sur le cours désiré ! Excellente journée à vous ! :)
Salut svp quel est la représentation de Lewis des éléments suivant 11Na ,13Al et 14Si
Bonjour, avez-vous essayé de contacter l’un de nos professeurs pour recevoir une aide personnalisée ? Bonne journée ! :)