Chapitres

Les éléments chimiques dans l'univers
On appelle élément chimique toute entité chimique symbolisée par une lettre (ex : O pour l'oxygène) et possédant un nombre déterminé de protons dans son noyau. Un élément chimique est présent dans la nature :
- soit sous la forme d'atome isolé
Ex : 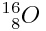
- soit sous la forme d'un ion
Ex : O 2 - (8 protons)
- soit sous la forme d'un isotope
Ex : 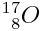
Ces trois notions constituent le contenu du chapitre.
Description et modèle de l'atome isolé
Définition
Le mot atome vient du Grec atomos qui signifie indivisible ou insécable. L'atome est donc la plus petite partie indivisible de la matière.
Modèle et composition de l'atome
L'atome est constitué d'un noyau sphérique autour duquel gravitent des électrons suivant des trajectoires complètement désordonnées qui forment le nuage électronique. Entre, règne du vide. Le noyau, lui, est composé de particules appelées nucléons. Il existe deux types de nucléons :
- les neutrons, particules non chargées ;
- les protons, particules chargées positivement.
Les électrons sont chargés négativement.
On appelle numéro atomique ou nombre de charges le nombre de protons contenus dans le noyau d'un atome donné. On le note Z.
On appelle nombre de masse le nombre de nucléons contenus dans le noyau d'un atome donné. On le note A.
Remarque :
Le nombre de neutrons peut se noter N. On a alors A = Z - N.
Dimensions de l'atome
L'atome est une sphère dont le rayon, appelé rayon atomique, est toujours de l'ordre de 10- 10 m.
Exemple :
Plus petit rayon : atome d'hydrogène : 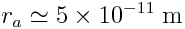
Plus grand rayon : atome de césium : 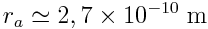
Le rayon du noyau, en revanche est toujours de l'ordre de 10- 15 m.
Donc :
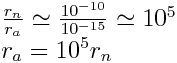
Conclusion :
Le noyau d'un atome occupe une partie infime de l'espace occupé par l'atome. L'atome contient donc en majeur partie du vide : on dit que l'atome a une structure lacunaire. Cette propriété a été mise en évidence par Rutherford en 1909 (cf. : Expérience de Rutherford).
Masse de l'atome
Les neutrons ont une masse mn = 1,675 x 10- 27 kg.
Les protons ont une masse mp = 1,673 x 10- 27 kg.
Les électrons ont une masse me = 9,1 x 10- 31 kg.
Tous les nucléons ont à peu près la même masse.
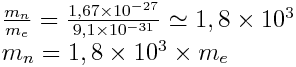
Il faudrait environ 1 800 fois plus d'électrons que de protons pour que dans un atome, noyau et nuage électronique aient la même masse. Or, ceci est impossible pour l'équilibre de la charge.
→ L'essentiel de la masse de l'atome est concentré dans son noyau.
Charge électronique dans un atome
Unité de charge électrique
On appelle charge électrique et on la note q la quantité d'électricité contenu dans une pile, un atome, tout objet chargé…
Elle s'exprime en Coulomb de symbole C.
Charge dans un atome
Un neutron a une charge nulle : qn = 0 C.
Un proton a une charge positive : qp = + e = 1,6 x 10- 19 C.
Un électron a une charger négative : qe = - e = 1,6 x 10- 19 C.
Un atome est électriquement neutre.
→ Pour que toutes ces propositions soient vraies, il faut nécessairement que dans un atome, il y ait autant de protons que d'électrons.
Remarque :
e = 1,6 x 10- 19
C est appelé charge élémentaire. Elle correspond à la plus petite valeur de charge électrique rencontrée dans la nature.
Représentation symbolique du noyau
Un atome donné peut être caractérisé par la description de son noyau suivant la représentation : 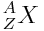
Exemple :
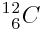
12 nucléons dont 6 protons et 6 neutrons.
6 électrons.
Quelques atomes à connaître
Hydrogène 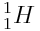
Carbone 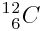
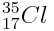
Azote 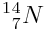
Oxygène 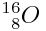
Fluore 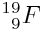
Sodium 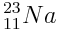
Aluminium 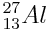
Chlore 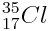
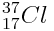
Exercice d’application
L’atome de titane est représenté par :
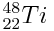
1) Donner la composition complète d’un atome de titane en le justifiant.
2) Calculer le quotient de la masse du noyau du la masse du nuage électronique. Conclure.
3) Combien d’atome de titane sont contenus dans un morceau de titane de masse mTi = 48,0 g.
4) Calculer l’espace occupé par un atome de titane en nm3 et m3.
Données : RTi = 132 pm.
1) D’après 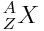
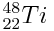
L’atome est électriquement neutre et la charge d’un électron est la même que celle d’un proton au signe près. Donc l’atome contient autant d’électrons que de protons, c'est-à-dire 22 dans le cas de l’atome de titane.
2) Soit mnoyau la masse du noyau.
Soit mp la masse d’un proton.
Soit mn la masse d’un neutron.
Soit mélec la masse du nuage électronique.
Soit me la masse d’un électron.
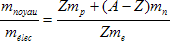
A.N. : A = 48
Z = 22
mp = 1,673 x 10- 27 kg
mn = 1,675 x 10- 27 kg
me = 9,1 x 10- 31 kg
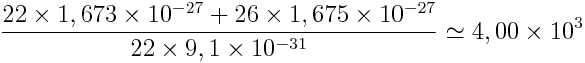
→ Le noyau est environ 4 000 fois plus lourd que le nuage électronique donc l’essentiel de la masse de l’atome est contenu dans le noyau.
3) Soit ma la masse de l’atome de titane.
Soit N le nombre de d’atomes contenus dans l’échantillon.
D’après le résultat de la question 2) :
ma ≈ mnoyau = Zmp + (A - Z) mn
mTi = N x ma
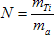
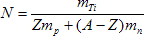
A.N. : mTi = 48,0 g = 4,8 x 10- 2 kg
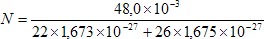
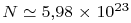
4) Soit VTi le volume d’un atome de titane
D’après le volume de la boule : 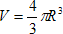
Ici : 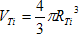
A.N. : RTi = 132 pm = 1,32 x 10-10 m
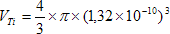
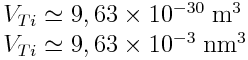
Les isotopes
Définition
Un isotope est un atome ayant même nombre de protons et d’électrons que son homologue mais un nombre de neutron, donc de nucléons, différents.
Ex : il existe 3 formes de l’élément carbone.
| Carbone 12 isolé | Carbone 13 isotope | Carbone 14 isotope |
Abondance relative des isotopes
Parmi les différentes formes le vendredis d’un même élément chimique, l’une d’entre elles est toujours présente de façon largement dominante.
Exemple :
Dans un cristal, il n’y a que des atomes de carbone : 28,9 % sont des carbones 12, 1,1 % sont des carbones 13 et le carbone 14 est à l’état de trace.
Remarque :
Exceptionnellement, l’élément chimique hydrogène possède un isotope appelé différemment : c’est le deutérium, symbolisé par 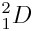
Les ions monoatomiques
Définitions
Un ion est un « atome » qui a perdu ou gagné un ou plusieurs électrons.
Remarque :
Dans tous les cas, si un atome devient un ion, son noyau reste intact.
Il existe deux types d’ion
Les anions
Un anion est ion qui a gagné un ou plusieurs électrons. Il a donc gagné des charges élémentaires : il est donc chargé négativement.
Exemple :
Le chlore 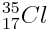
Il gagne un électron et donne naissance à l’ion chlorure Cl - qui possède toujours 17 protons mais 18 électrons.
Les cations
Un cation est ion qui a perdu un ou plusieurs électrons. Il a donc perdu des charges élémentaires : il est donc chargé positivement.
Exemple :
Le sodium 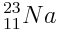
Il perd un électron et donne naissance à l’ion sodium Na + qui possède toujours 11 protons mais 10 électrons.
Représentation de l’ion
| CATIONS | ANIONS |
| Symbole de l'élément Xn + n = 1, 2 ou 3 est le nombre : | Symbole de l'élément Xn - n = 1, 2 ou 3 est le nombre : |
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour à tous, j’aimerai savoir si tous les isotopes naturels et artificiels existent dans l’univers (pas dans la nature) ? Merci
bonjour je dois calculer le nombre d atomes de fer dans un echantillon qui fait 140 g.
je dois aussi calculer la masse d un atome de fer
je n ai pas vu cette lecon en cours juste pendant le confinement mais je ne comprend pas la lecon
merci
Bonjour ! Pour calculer la masse d’un atome, il suffira d’additionner le nombre de protons (Z) et le nombre de neutrons (n).
Pour le nombre d’atomes : Si on part du principe que la masse = 150 g, sachant que la masse d’un atome fer est égale à 9,3.10-23 g se calcul ainsi : N = 150 / 9.3.10-23
Bonne journée !
Je n’arrive pas a faire le schéma de Lewis de l’ion H+
Bonjour ! Je ne peux malheureusement pas vous le reproduire en commentaire, mais je vous invite à lire cet article qui pourrait vous aider : https://www.superprof.fr/ressources/scolaire/physique-chimie/premiere-s/structure-de-la-matiere/liaison-lewis.html
Bonne journée !
coucou les amis je veux apprendre la physique svp
Bonjour ! Je vous invite à consulter tous nos cours dans ce domaine, il y a fort à parier que vous trouviez votre bonheur : https://www.superprof.fr/ressources/scolaire/physique-chimie/
Bonne découverte, et bonne journée !
Très bien ton document. C’est du bon boulot !
marco, prof de physique
Tu devrais plutôt poser ta question dans le forum
svp pourez tu mexpliquer comment equilibrer une equation