Chapitres
- 01. Les 18 premiers éléments du tableau périodique
- 02. Tableau périodique réduit : les 20 premiers éléments
- 03. Découvrir le tableau périodique des éléments
- 04. Tableau périodique réduit des éléments de Mendeleïev
- 05. Utilisation de la classification périodique
- 06. En savoir plus sur le cortège électronique qui permet de classifier les atomes dans le tableau périodique des éléments ?
La classification périodique des éléments, ou tableau périodique de Mendeleïev, ordonne les éléments chimiques par propriétés similaires et numéros atomiques croissants.
Créé par Dmitri Mendeleïev en 1869, il prédit les propriétés manquantes et fonde la chimie moderne. Mise à jour, la version actuelle inclut jusqu'à l'élément 118 et reste un pilier de l'enseignement et de la recherche.
Découvrez-en plus dans notre article !

Les 18 premiers éléments du tableau périodique
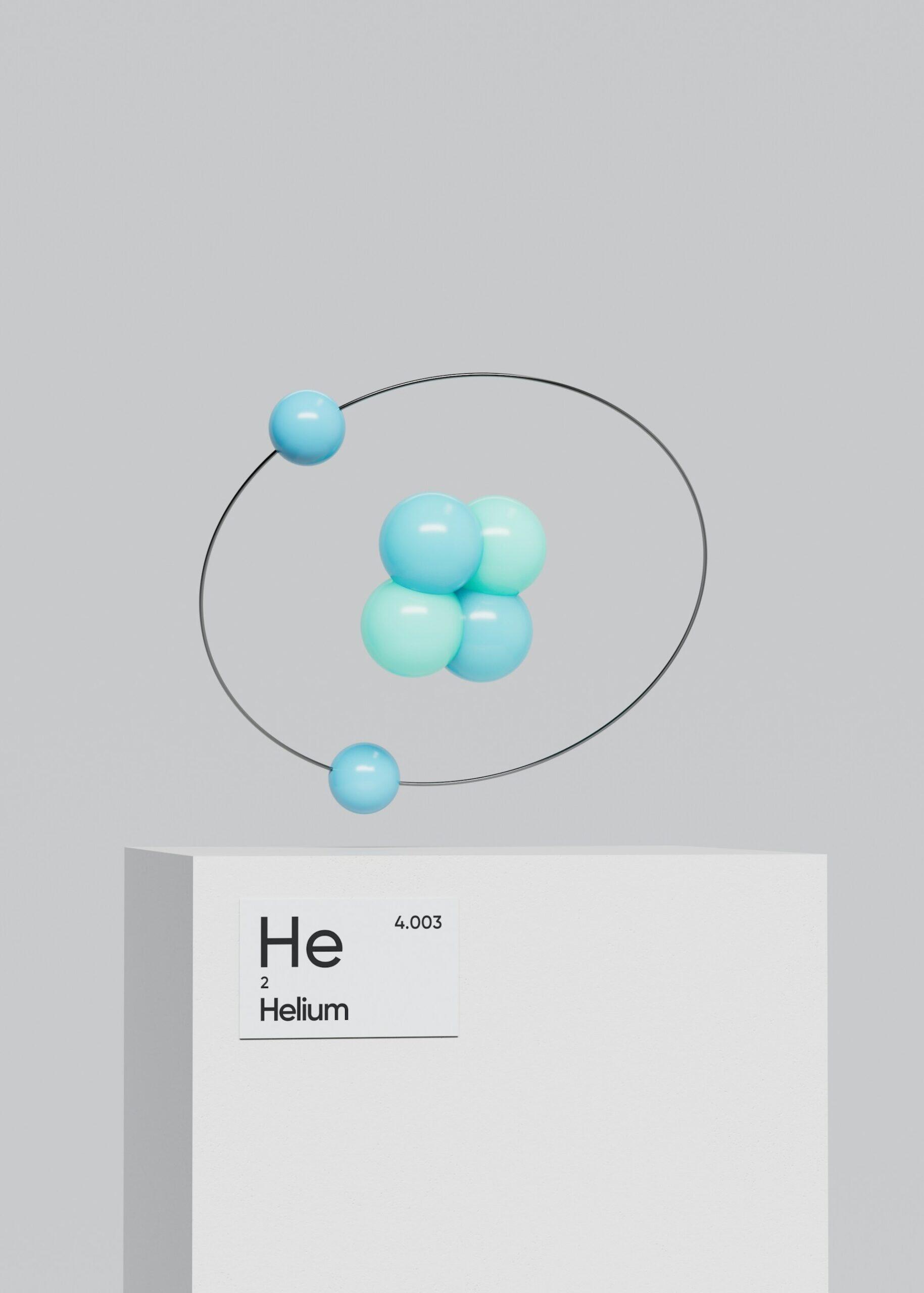
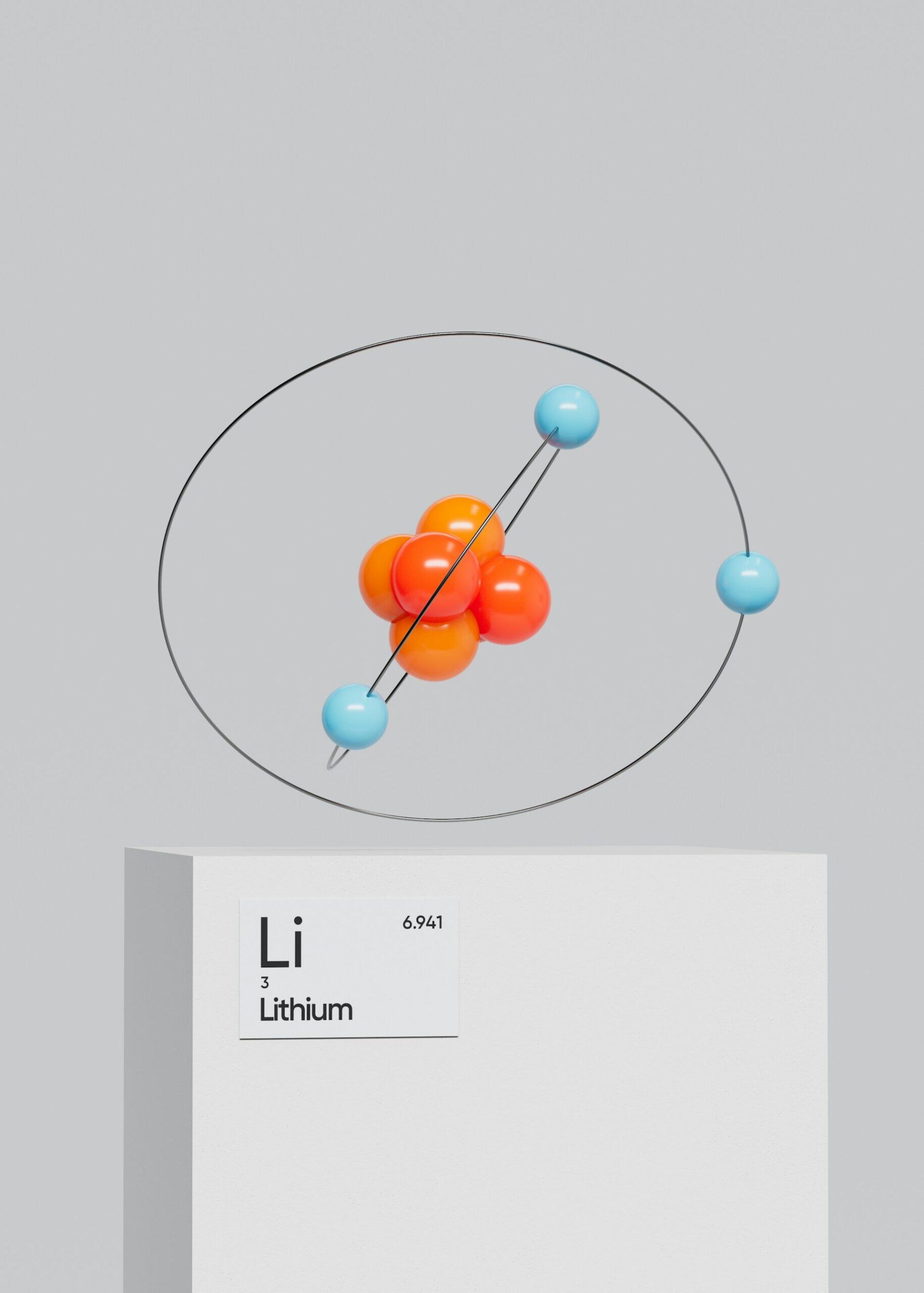
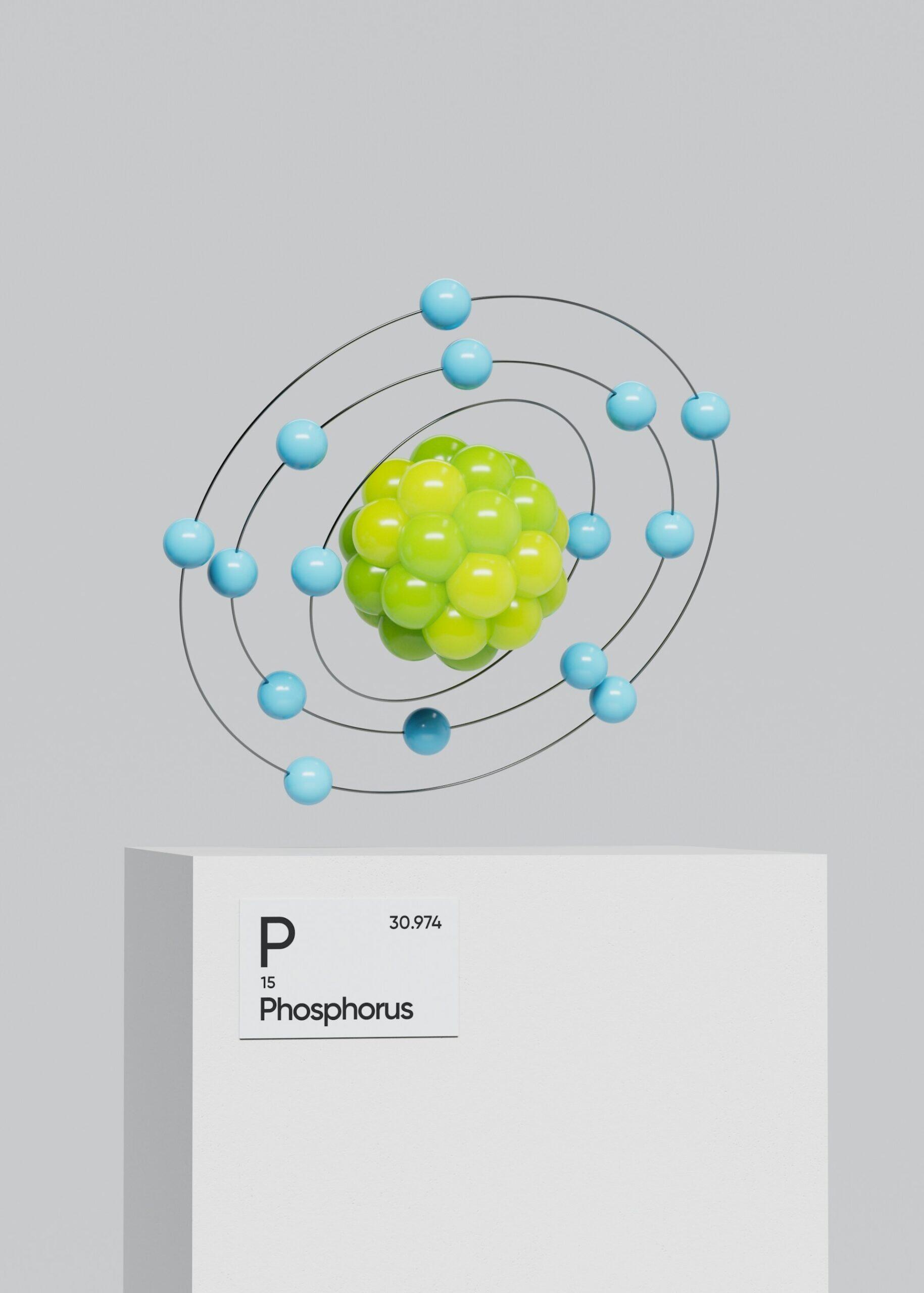
Voici une liste récapitulative pour ne pas les oublier :
| № | Nom | Symbole | Catégorie du nom | Origine du nom | Fait intéressant |
|---|---|---|---|---|---|
| 1 | Hydrogène | H | Pré-chimique / Grec | “hydro-” (eau) + “-genes” (qui engendre) | Élément le plus abondant dans l’Univers |
| 2 | Hélium | He | Corps céleste / Grec | “Helios” = le Soleil | Découvert d’abord dans le spectre solaire |
| 3 | Lithium | Li | Minéral / Grec | “lithos” = pierre | Utilisé dans les batteries |
| 4 | Béryllium | Be | Minéral / Béryl | Du minéral béryl | Très léger, bon conducteur thermique |
| 5 | Bore | B | Arabe / Minéral | Du borax (“buraq”) | Utilisé dans le verre et la céramique |
| 6 | Carbone | C | Latin / Pré-chimique | “carbo” = charbon | Base de la chimie organique |
| 7 | Azote | N | Grec / Pré-chimique | “a-” (sans) + “zôê” (vie) | Constitue \~78 % de l’air |
| 8 | Oxygène | O | Grec / Pré-chimique | “oxys” (acide) + “genes” (qui engendre) | Indispensable à la respiration |
| 9 | Fluor | F | Latin / Pré-chimique | “fluere” = couler | Gaz très réactif |
| 10 | Néon | Ne | Grec / Nom construit | “neos” = nouveau | Utilisé dans les enseignes lumineuses |
| 11 | Sodium | Na | Arabe-Latin / Minéral | “natrium” (latin), “al-kali” (arabe) | Réagit violemment avec l’eau |
| 12 | Magnésium | Mg | Lieu / Minéral | Région de Magnésie en Grèce | Utilisé dans les alliages légers |
| 13 | Aluminium | Al | Latin / Minéral | “alumen” = alun | Résistant à la corrosion |
| 14 | Silicium | Si | Latin / Minéral | “silex” = pierre dure | Base des semi-conducteurs |
| 15 | Phosphore | P | Grec / Pré-chimique | “phos” (lumière) + “phoros” (porteur) | Brille dans l’obscurité (forme blanche) |
| 16 | Soufre | S | Latin / Pré-chimique | “sulphur” = soufre | Utilisé dans engrais et produits chimiques |
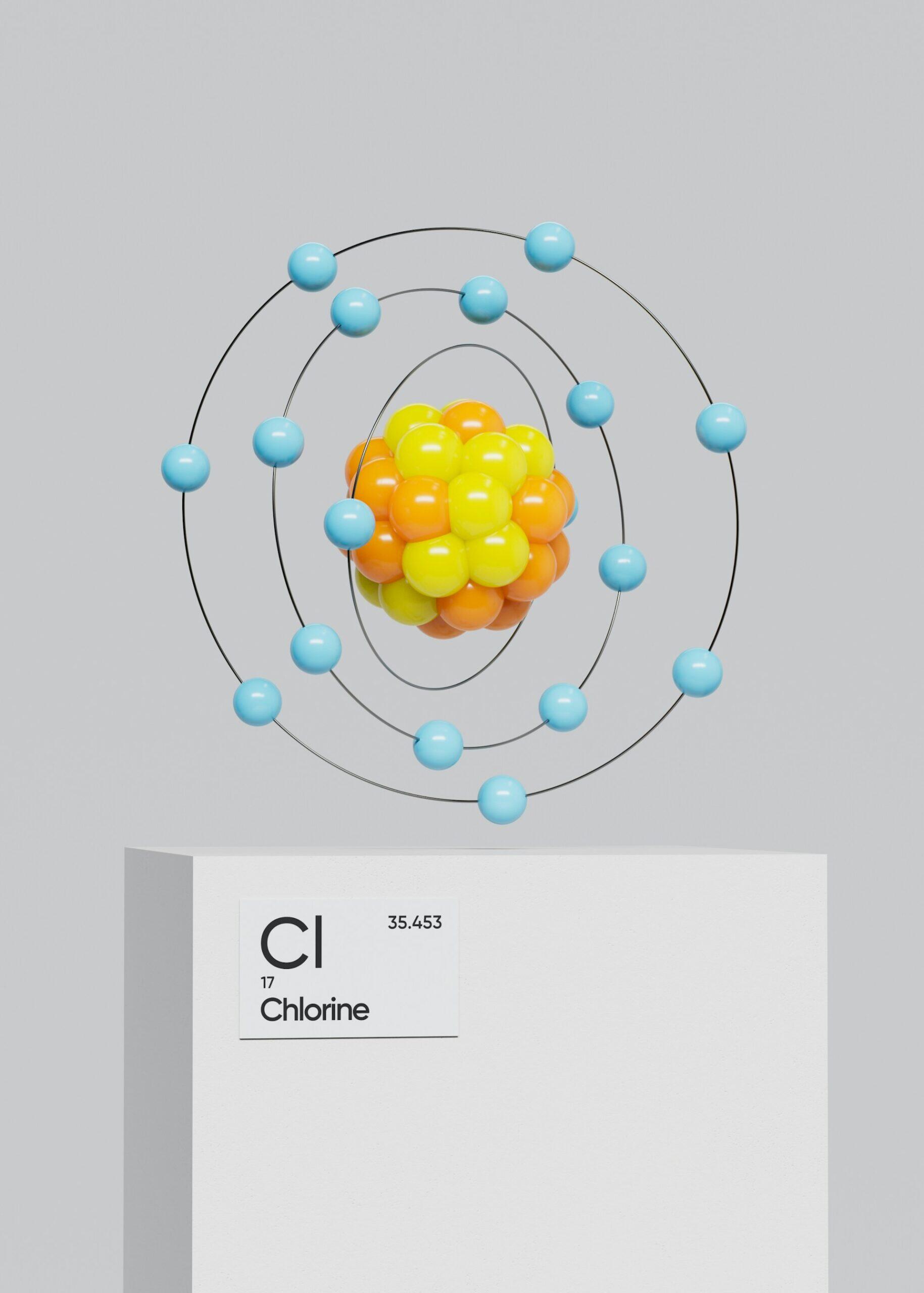
| 17 | Chlore | Cl | Grec / Couleur | “chloros” = vert pâle | Gaz toxique, désinfectant puissant |
| 18 | Argon | Ar | Grec / Nom construit | “argos” = inerte | Gaz noble très stable, utilisé dans l’éclairage |

Tableau périodique réduit : les 20 premiers éléments

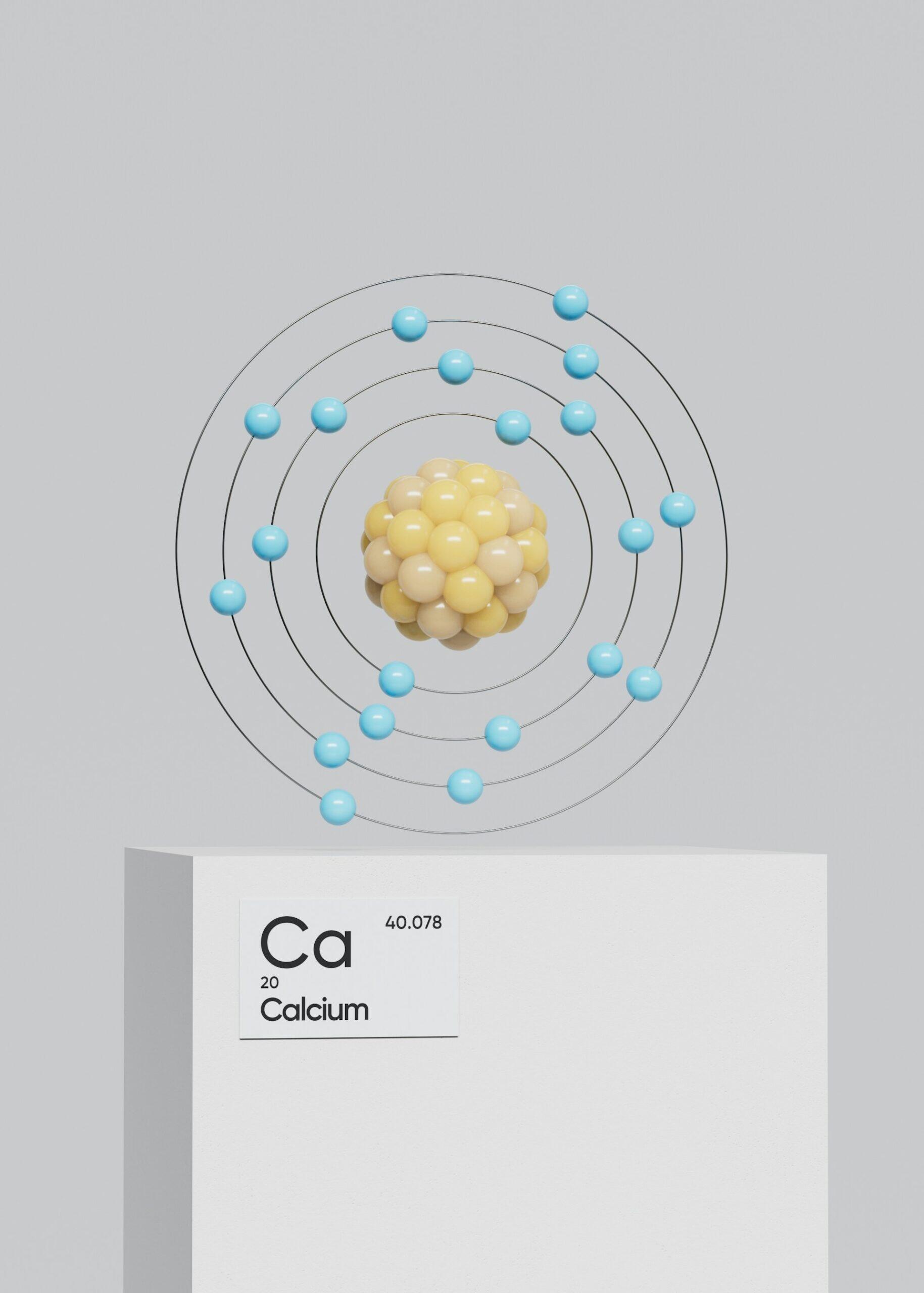
Voici une liste récapitulative des 20 premiers éléments du tableau :
| Nom de l’élément | Symbole | Catégorie du nom | Origine du nom | Fait intéressant |
|---|---|---|---|---|
| Hydrogène | H | Grec | « hydro » (eau) + « genes » (engendrer) | C’est l’élément le plus abondant de l’univers. |
| Hélium | He | Grec | « helios » (soleil) | Découvert dans le spectre solaire avant d’être trouvé sur Terre. |
| Lithium | Li | Grec | « lithos » (pierre) | Utilisé dans les batteries rechargeables. |
| Béryllium | Be | Minéral | Du béryl, un minéral | Très léger, il est utilisé dans l’aérospatiale. |
| Bore | B | Arabe | « buraq » (borax) | Sert dans les verres spéciaux et les détergents. |
| Carbone | C | Latin | « carbo » (charbon) | Base de la chimie organique. |
| Azote (Nitrogène) | N | Grec | « nitron » + « genes » (engendrer) | 78 % de l’atmosphère terrestre. |
| Oxygène | O | Grec | « oxys » (acide) + « genes » | Indispensable à la respiration. |
| Fluor | F | Latin | « fluere » (couler) | Utilisé dans le fluorure pour protéger les dents. |
| Néon | Ne | Grec | « neos » (nouveau) | Employé dans les enseignes lumineuses. |
| Sodium | Na | Arabe/latin | « soude » / « natrium » | Réagit violemment avec l’eau. |
| Magnésium | Mg | Localité | Magnesia, région de Grèce | Brûle avec une lumière blanche intense. |
| Aluminium | Al | Minéral | « alun » (alum) | Métal léger et résistant à la corrosion. |
| Silicium | Si | Latin | « silex » (caillou) | Essentiel dans les semi-conducteurs. |
| Phosphore | P | Grec | « phôs » (lumière) + « phoros » (porteur) | Brille dans l’obscurité. |
| Soufre | S | Latin | « sulfur » | Utilisé dans les allumettes et les engrais. |
| Chlore | Cl | Grec | « chloros » (vert pâle) | Désinfectant courant dans l’eau potable. |
| Argon | Ar | Grec | « argos » (inerte) | Gaz noble, ne réagit presque jamais. |
| Potassium | K | Arabe/latin | « al-qali » (cendre) / « kalium » | Indispensable au fonctionnement des muscles. |
| Calcium | Ca | Latin | « calx » (chaux) | Élément majeur des os et des dents. |

Découvrir le tableau périodique des éléments
Le tableau périodique des éléments est constitué de 118 éléments chimiques dont 83 sont considérés comme primordiaux puisque ceux-ci possèdent au moins un isotope stable ou tout du moins suffisamment stable pour être plus ancien que la Terre.
Aujourd'hui, on compte
éléments chimiques dans le tableau
☢️ Parmi ces éléments considérés comme primordiaux, on en compte trois qui sont radioactifs :
L'uranium 92U
Le thorium 90Th
Le bismuth 83Bi
On trouve également 11 éléments présents naturellement sur Terre bien qu'ils soient beaucoup trop radioactifs pour que leurs isotopes, présents lorsque le système solaire eut été formé, existent encore à l'heure actuelle. En effet, ils se forment de façon continue grâce au mécanisme de la désintégration radioactive d'autres éléments chimiques tel que l'uranium ou encore le thorium.
On peut notamment prendre l'exemple du technétium 43Tc, le plus léger d'entre eux, qui est produit grâce à la fission de l'uranium
Les 24 derniers éléments du tableau périodique des éléments sont, quant à eux, considérés comme étant synthétiques. En effet, ils n'existent pas de façon naturelle dans l'environnement terrestre puisqu'ils sont produits de façon artificielle au sein de réacteurs nucléaires ou encore de façon expérimentale dans les laboratoires d'étude. Il reste cependant possible de trouver des traces de ces éléments synthétiques dans la naturel notamment à la suite d'essais nucléaires atmosphériques ou encore à cause d'accidents nucléaires.
C'est donc pour cela que l'on peut trouver dans certaines zones contaminées de l'américium 95Am, du curium 96Cm, du berkélium 97BK et du californium 98Cf
Bien qu'ils soient considérés comme étant synthétiques, il est possible de retrouver de façon naturelle certains de ces éléments atomiques mais ailleurs que sur Terre. En effet, certains éléments comme l'einsteinium 99Es peuvent être produit de façon naturel lors de l'explosion de supernovae.
Il est intéressant aussi de savoir que, parmi les 103 éléments dont l'état standard est connu dans des conditions normales de température et pression, c'est à dire 0°C et 1 atm, on trouve :
- 90 éléments solides
- 11 sous la forme gazeuse
- Seulement 2 éléments liquides :
- Le brome 95Br dont la température de fusion est de -7,2°C
- Le mercure 80°C fondant à -38,8°C
Malgré tout, parmi les éléments solides dans des conditions normales de pression et de température, beaucoup gardent un point de fusion proche de la température ambiante.
C'est notamment de cas du :
- Francium 87Fr dont la température de fusion est de 27°C
- Césium 55Cs dont la température de fusion est de 28,5°C
- Gallium 31Ga dont la température de fusion est de 29,8°C
- Rubidium 37Rb dont la température de fusion est de 39,3°C
- Et du phosphore blanc 15P dont la température de fusion est de 44,2°C
Tableau périodique réduit des éléments de Mendeleïev

Le tableau périodique des éléments, également connu sous le nom de tableau de Mendeleïev, de classification périodique des éléments ou simplement de "tableau périodique", représente tous les éléments chimiques classés par numéro atomique croissant et organisés en fonction de leur configuration électronique, qui régit leurs propriétés chimiques.
Le tableau possède :
- Des périodes (rangées)
- Des groupes (colonnes) basés sur les configurations électroniques
- Chaque élément est représenté par un symbole et un numéro atomique
L'idée de ce tableau est généralement attribuée au chimiste russe Dmitri Ivanovitch Mendeleïev, qui construisit en 1869 un tableau différent de celui que nous utilisons aujourd'hui, mais similaire dans son principe, et dont le but principal était de proposer une classification systématique des éléments connus à l'époque afin de :
- Mettre en évidence la périodicité de leurs propriétés chimiques
- Identifier les éléments qui restaient à découvrir
- Voire de prédire certains éléments alors inconnus et certaines de leurs propriétés
Depuis lors, le tableau périodique a subi plusieurs modifications, pour aboutir à la forme que nous connaissons aujourd'hui.
Il a évolué pour devenir une référence mondiale à laquelle toutes les formes de comportement physique et chimique des éléments peuvent être comparées. Depuis la mise à jour de l'UICPA le 28 novembre 2016, sa forme standard compte 118 éléments, allant de l'hydrogène 1H à l'oganesson 118Og
L'origine du tableau périodique des éléments
La classification périodique des éléments, aussi appelée tableau de Mendeleïev, est issue du nom de son créateur. C'est un chimiste russe qui en 1869 créa un tableau dont le but était de regrouper tous les éléments chimiques connus par points communs (groupes et familles par exemple). Il a souvent été ajusté et mis à jour depuis cette époque.
Sa dernière révision date de 2016 par l'UICPA (Union internationale de chimie pure et appliquée), une ONG suisse qui a pour but l'évolution de la physique-chimie. Le tableau périodique compte à ce jour 118 éléments.
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. C'est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologie des éléments chimiques et leurs dérivé via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.
Construction du tableau périodique des éléments
Rappelons-le, le tableau périodique des éléments est construit selon les propriétés physico-chimiques des éléments. Or, dans la mesure où ces propriétés reposent sur la configuration électronique de l'élément, la construction du tableau périodique dépend également de cette donnée.
- En effet, chaque ligne du tableau, également appelée période, correspond à une couche électronique identifiée par ce qu'on appelle le nombre quantique principal noté n dans le tableau
- Ainsi, puisqu'il existe à ce jour sept couches électroniques connues à l'état fondamental, on trouve donc sept lignes dans le tableau périodique standard
- De plus, chaque période est divisée en plusieurs blocs, entre un et quatre selon les périodes, qui correspondent, quant à eux, aux sous-couches électroniques que l'on peut identifier grâce à leur nombre quantique secondaire qui est noté ℓ
- Il existe quatre types de sous-couches électroniques connues à l'état fondamental que l'on note s, p, d et f qui ont pour origine les abréviations utilisées en spectroscopie. Chacune de ces sous-couches électronique contiennent respectivement 1, 3, 5 et 7 orbitales atomiques que l'on peut identifier grâce à leur nombre quantique magnétique que l'on note mℓ.
- À cela, il faut ajouter le fait que chaque orbitale est occupée par, au plus, deux électrons qui sont chacun identifiés grâce à leur nombre quantique magnétique de spin noté ms.
Utilisation de la classification périodique

Familles chimiques
Les propriétés chimiques des atomes des différents éléments (transformation en ions monoatomiques ou capacité à établir une ou plusieurs liaisons covalentes) dépendent essentiellement du nombre d'électrons présents dans leur couche externe.
Or, les atomes des éléments appartenant à une même colonne du tableau périodique possèdent justement le même nombre d'électrons dans leur couche externe. On peut donc légitimement supposer que les atomes des éléments d'une même colonne ont des propriétés très semblables, même si elles ne sont pas rigoureusement identiques. On dit que les éléments d'une même colonne constituent une famille chimique.
- Les éléments de la première colonne, notée (1),(à l'exception de l'hydrogène) constituent la famille des métaux alcalins
- Les éléments de la deuxième colonne, notée (2), constituent la famille des métaux alcalino-terreux
- Les éléments de la dix septième colonne, notée (7) dans la présentation réduite, constitue la famille des halogènes
- Les éléments de la dix huitième colonne, notée (8) dans la présentation réduite, constitue la famille des gaz rares (ou gaz inertes)
Prévision du nombre de liaisons covalentes que peut établir un atome
Le nombre de liaisons covalentes que peut établir un atome dépend du nombre d'électrons que présente cet atome sur sa couche externe. Rappelons que :
- Pour l'hydrogène dont seule la couche K est concernée, la règle du duet permet de prévoir que cet atome peut donner une liaison covalente.
- Pour les atomes des autres éléments dont les couches externes sont L ou M et qui possèdent p électrons dans cette couche externe (ils appartiennent alors à la colonne p), la règle de l'octet permet de prévoir qu'ils peuvent établir 8-p liaisons covalentes.
✅ Exemple : L'oxygène se situe dans la colonne p=6.
Un atome d'oxygène pourra établir un nombre n(liaisons) de liaisons covalentes tel que :
| n(liaisons)=8-p | => | n(liaisons)=8-6 | => | n(liaisons)=2 |
Prévision de la charge d'un ion monoatomique
La règle de l'octet permet de prévoir que les atomes des éléments de :
- La colonne (1) possèdent un électron sur leur couche externe. Ils ont tendance à le perdre pour donner un ion portant une charge positive (cation). Exemples: Li+, Na+ etc….
- La colonne (2) possèdent deux électrons sur leur couche externe. Ils ont tendance à les perdre pour donner un ion portant deux charges positives. Exemples: Be2+, Mg2+ etc….
- La colonne 13, notée (3) dans la présentation réduite, possèdent trois électrons sur leur couche externe. Ils ont tendance à les perdre pour donner un ion portant trois charges positives. Exemples: B3+, Al3+ etc….
- La colonne 17, notée (7) dans la présentation réduite, possèdent sept électrons sur leur couche externe. Ils ont tendance à gagner un électron pour donner un ion portant une charge négative (anion). Exemples: F-, Cl- etc….
En savoir plus sur le cortège électronique qui permet de classifier les atomes dans le tableau périodique des éléments ?
Pour débuter : le cas concret de l'atome d'hydrogène
Nous avons déjà rencontré le modèle probabiliste de l'atome d'hydrogène (fiche "atome et élément"). Rappelons que dans ce modèle, les points présents sur le schéma représentent la probabilité de trouver l'unique électron de cet atome à un instant donné. L'électron a d'autant plus de chance de se trouver dans une région de l'espace autour du noyau qu'il y a de points dans cette zone.
Il apparaît sur le schéma ci-contre une zone sphérique, centrée sur le noyau, d'épaisseur faible et de rayon moyen r=53pm, dans laquelle l'électron a de grandes chances de se trouver.
On dit que l'électron appartient à une couche dont le rayon moyen est 53pm.
Étude plus générale
Un atome quelconque possède Z électrons dans son cortège électronique. Comme pour l'atome d'hydrogène, les électrons d'un atome quelconque se répartissent autour du noyau sur de couches.
⚛️ Les électrons d'un atome (ou d'un ion monoatomique) ne sont pas tous liés de la même façon au noyau :
- Ceux qui sont proches du noyau y sont très liés (par des forces)
- Ceux qui en sont plus éloignés y sont moins liés
- Les électrons qui appartiennent à une même couche sont donc situés à la même distance moyenne du noyau et sont liés de la même façon à ce noyau
La couche la plus proche du noyau est notée K, les suivantes sont notées dans l'ordre croissant d'éloignement: L, M, N, O, P, Q. Cette année nous ne considérerons que les trois premières couches.
La couche de valence
On appelle couche de valence d’un atome la dernière couche électronique remplie. Ce sont les électrons qui composent cette dernière couche de valence qui interviennent dans les réactions chimiques.
Remarques
État fondamental
Les électrons peuvent être répartis de différentes façons dans les différentes couches. Les règles de répartitions données ci-dessous concernent ce que nous appellerons l'atome dans son état fondamental. C'est la seule répartition à connaître dans le programme de la classe de seconde.
Définitions
La couche la plus éloignée du noyau qui contient des électrons est appelée couche externe.
Les électrons de cette couche externe sont appelés électrons périphériques.
Règles de remplissage des couches électroniques
Première règle
Une couche électronique ne peut contenir qu'un nombre limité d'électrons.
- La couche K (première couche) peut contenir un maximum de 2 électrons (c'est-à-dire qu'elle peut contenir 0; 1 ou 2 électrons) ;
- La couche L (deuxième couche) peut contenir un maximum de 8 électrons (c'est-à-dire qu'elle peut contenir 0; 1;...;7 ou 8 électrons) ;
- La couche M (troisième couche) peut contenir un maximum de 8 électrons (seulement pour les éléments tels que Z<18).
Lorsqu'une couche est pleine on dit qu'elle est saturée.
Deuxième règle
Le remplissage des couches électroniques s'effectue en commençant par la couche K. Lorsqu'elle est saturée on remplit la couche L et ainsi de suite.
Répartition ou formule électronique d'un atome ou d'un ion monoatomique
Les règles de remplissage précédentes permettent d'établir la répartition électronique (ou formule électronique) d'un atome ou d'un ion atomique de la façon suivante :
- On détermine le nombre d'électrons à repartir (Z électrons pour un atome).
- On écrit, côte à côte et entre parenthèses, les lettres de chaque couche contenant des électrons.
- On indique, en haut et à droite de chaque parenthèse, le nombre d'électrons présents dans la couche considérée.
Exemple: pour un atome de carbone Z=6. Le noyau de cet atome possède donc 6 protons. Cet atome étant électriquement neutre, il possède 6 électrons qu'il faut répartir. En utilisant les règles précédentes, on établit la formule électronique du carbone. Soit: (K)2(L)4.






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Intelligent
C’est très intéressant j’aime beaucoup
Vraiment
Comment appelle-t-on les éléments des blocs s,p,d et f??
Bonjour, avez-vous essayé de contacter l’un de nos professeurs pour recevoir une aide personnalisée ? Excellente journée ! :)
Bonsoir’j’aimerais savoir comment sont appelé les éléments de la 10eme colnne
Pour ne pas oublier la deuxième période et la troisième j’ai une chanson:
Lit Bécha Bien Le Champ de Notre Oncle François Néon.
Napoléon Mangea Allégrement Six Poulets Sans Claqué Argon.
Ça se mémorise plus facilement.
J’ai vraiment apprécié et beaucoup aimé la chimie et je veux être un chimiste.
Bonjour,
Tout d’abord merci pour votre article, j’aimerais savoir pourquoi la colonne possédant trois électrons sur leur couche externe est nommée (13) , de même pour la colonne (17) qui possède 7 électrons sur sa couche externe alors que les colonnes 1 et 2 sont nommées après le nombre d’électrons sur leur couche externe?
Merci d’avance