Chapitres
La lumière est un rayonnement électromagnétique qui possède une double nature : celle d'une onde lumineuse et celle d'un corps constitué de particules élémentaires appelées photons. Il est possible de décomposer la lumière selon ses différentes composantes pour obtenir son spectre, une image riche en informations sur sa source ou les milieux qu'elle a traversés.

La lumière, une onde et un corps ?

Il existe trois types différents d’ondes :
- Mécanique : Les ondes magnétiques nécessitent une matière qui se déforme afin de se propager. Ce matériau a la capacité recouvrer son état initial grâce aux forces de restauration qui inversent la déformation ;
- Électromagnétique : Les ondes électromagnétiques quant à elles n’ont pas besoin de support pour se déplacer : elles correspondent à des oscillations périodiques de champs électriques et magnétiques qui peuvent alors se déplacer dans le vide ;
- Gravitationnelle : Les ondes gravitationnelles n’ont plus de support pour se déplacer puisque ce sont les déformations de la géométrie de l’espace-temps qui se propagent.
Une onde est une déformation ou une vibration qui se propage dans un milieu défini. La lumière est une onde lumineuse constituée de particules : les photons.
- Lorsqu'une particule est plus petite qu'un atome, en particulier le noyau, on l'appelle une particule subatomique
- Ces éléments sont analysés en physique des particules.
☀️ L'atmosphère, les nuages, le sol ou l'océan reçoivent la lumière du soleil. ils en ont rendu une partie
Lumière dans toutes les directions : on dit qu'ils diffusent la lumière.
La lune, les planètes, les comètes et tous les corps célestes du système solaire sont éclairés par le Soleil. Ils sont visibles car leur surface diffuse une partie de la lumière du soleil.
Le spectre électromagnétique et la longueur d'onde
Définition de la longueur d'onde (λ)
La longueur d’onde (λ) est une grandeur physique caractéristique d’une onde monochromatique (d’une seule couleur). Dans un milieu homogène, elle définit la distance séparant deux maxima consécutifs de l’amplitude. Elle est notée avec la lettre grecque lambda (λ). L'unité légale (SI) est le mètre (m), bien que l'on utilise souvent le nanomètre (nm) pour la lumière (1 nm = 10-9 m).
L'énergie (E) des photons, quant à elle, est inversement proportionnelle à la longueur d'onde selon la formule suivante, où h est la constante de Planck :
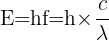
Le spectre visible et ses limites
Le spectre visible est la seule partie du rayonnement électromagnétique que l'œil humain peut percevoir, grâce aux cônes de la rétine. Ces longueurs d’onde sont généralement comprises entre 400 nm et 700 nm.
Les rayonnements proches de 400 nm sont le violet. Au-delà, on trouve les ultraviolets (UV).
Les rayonnements proches de 700 nm sont le rouge. Au-delà, on trouve les infrarouges (IR).
Décomposition de la lumière et réfraction
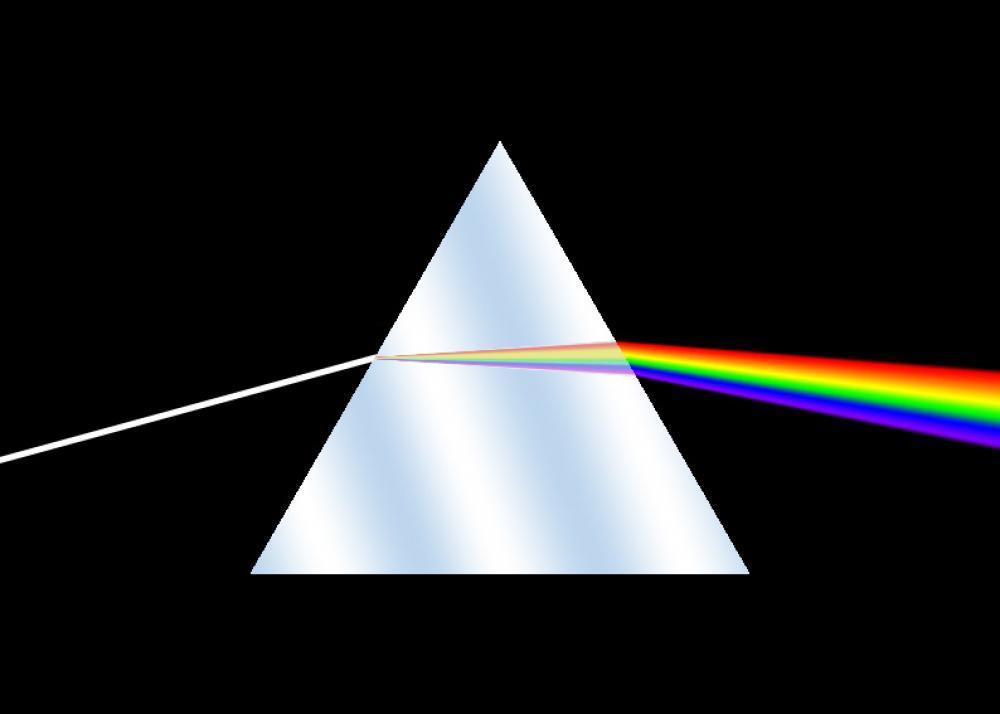
La décomposition de la lumière (comme la lumière blanche polychromatique) est le phénomène qui permet d'obtenir son spectre. Cette décomposition est généralement réalisée par un prisme (ou une goutte d'eau dans le cas d'un arc-en-ciel), grâce au phénomène de réfraction.
Le phénomène de réfraction
La réfraction de la lumière correspond au changement de direction d'un rayon lumineux lorsqu'il traverse la surface (appelée dioptre) séparant deux milieux d’indices de réfraction différents. Un milieu est caractérisé par son indice de réfraction ($n$) :
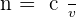
Où c est la célérité de la lumière dans le vide et v est sa vitesse dans le milieu considéré.
Loi de Snell-Descartes
La loi de Snell-Descartes de la réfraction exprime la relation entre les indices de réfraction (n1 et n2) et les angles (angle d'incidence i1 et angle de réfraction i2) :
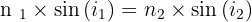
- Le rayon est dit incident avant le dioptre et réfracté après.
- Il y a réflexion totale lorsque le rayon réfracté se retrouve mathématiquement sur le dioptre, ce qui se produit lorsque le rayon passe d'un milieu plus réfringent à un milieu moins réfringent (n1 > n2).
Les différents types de spectres lumineux
Ce tableau résume les trois principaux types de spectres, leurs caractéristiques visuelles et ce qu'ils permettent de déterminer.
| Type de Spectre | Apparence | Origine (Source) | Information Déterminée |
|---|---|---|---|
| Continu (Émission) | Bandes de couleurs ininterrompues, du violet au rouge. | Corps à haute température (Solide, liquide, gaz haute pression). | La température de la source (plus c'est chaud, plus le pic est vers le violet). |
| De Raies (Émission) | Raies fines et colorées sur un fond noir. | Gaz d'atomes ou d'ions isolés excités électriquement ou thermiquement. | La nature chimique de l'élément (chaque élément a une "signature" unique). |
| D'Absorption | Spectre continu traversé par des raies noires. | Lumière à spectre continu traversant un gaz froid. | La composition chimique du gaz (ou de l'atmosphère d'une étoile, comme le Soleil). |
Les spectres d'émission
Les spectres d'émission sont constitués des rayonnements émis par un corps. On distingue deux types principaux : continus et de raies.

Comme leur nom l'indique, les spectres d'émission sont constitués des rayonnements émis par un corps. On distingue deux sortes de spectre d'émission :
Les spectres continus
Les spectres de raie
Les spectres continus
Expérimentalement, il est possible d’obtenir un spectre continu avec tout corps à haute pression et haute température. Ces spectres sont donc d'origine thermique, et l'émission de lumière est liée à la température de la source. Ce type de spectre comporte tous les rayonnements visibles sans discontinuité du violet au rouge.
Cependant, la proportion des différents rayonnements n'est en général pas la même : un spectre d'émission continu comporte toujours une longueur d'onde correspondant à une intensité plus forte que les autres.
On retrouve ce phénomène dans les lampes et ampoules d’usage quotidien. En effet, une lampe à incandescence classique, qui produit de la lumière en chauffant un filament de tungstène à l’aide du courant électrique, présentera une plus forte intensité de radiations rouges au sein de son profil spectral. Cela explique la couleur légèrement rouge-orangée des lampes à incandescence.
Cette longueur d'onde de plus forte intensité, qui correspond à un maximum d'émission, permet de déduire la température du corps émetteur. Plus cette longueur d'onde est faible (décalé vers le violet), plus la température est élevée.

Les spectres continus permettent donc de déterminer la température de leur source. C'est ainsi que la température de surface d'une étoile peut être connue. Il est possible d’observer un spectre continu par la méthode dite de la décomposition de la lumière.
En effet, la lumière blanche du soleil ou des lampes à incandescence est composée de tous les rayonnements du spectre visible, qui sont donc de longueurs d’onde différentes et de couleurs différentes : elle est qualifiée de lumière polychromatique. En projetant de la lumière blanche à travers un prisme vers un écran, on peut apercevoir le spectre de la lumière blanche, semblable à un arc en ciel.
Le spectre continu (d'origine thermique)
Un spectre continu est obtenu avec tout corps à haute pression et haute température (solide, liquide, ou gaz sous haute pression). Ces spectres sont d'origine thermique : l'émission de lumière est liée à la température de la source. Ils comportent tous les rayonnements visibles sans discontinuité du violet au rouge.
La lumière blanche est le seul spectre continu visible par l'homme.
La couleur dominante du spectre continu permet de déterminer la température de la source : plus le maximum d'intensité est décalé vers le violet (courtes longueurs d'onde), plus la température du corps émetteur est élevée. C'est ainsi que l'on détermine la température de surface des étoiles.
Le spectre de raies d'émission
Ce type de spectre est obtenu par excitation électrique de gaz d'atomes isolés et d'ions monoatomiques en phase gazeuse (ex : lampe à vapeur). Il est constitué uniquement de quelques raies colorées sur fond noir, correspondant à un nombre limité de longueurs d'onde. La lumière est alors considérée comme monochromatique.
Ces raies résultent des transitions électroniques. L'énergie du photon émis correspond exactement à la différence entre les deux états d'énergie de l'électron :
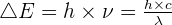
Chaque composé chimique possède son propre spectre de raie, ce qui le caractérise et permet de l'identifier.
Les spectres d'absorption
Principe de l'absorption
Un spectre d'absorption est obtenu lorsqu'une lumière blanche (spectre continu) traverse un corps gazeux froid (ou une solution colorée). Les photons du rayonnement sont absorbés par les atomes du gaz s'ils contiennent la quantité d’énergie précise nécessaire pour faire passer un électron à un niveau d’énergie supérieur. Ce photon disparaît du rayonnement, laissant des raies noires sur le spectre continu initial.
Complémentarité et identification chimique
Il existe une relation de complémentarité essentielle : les longueurs d'onde absorbées par une substance correspondent aux longueurs d'onde qu'elle est capable d'émettre. Par conséquent, les raies noires d'absorption d'une substance se situent exactement aux mêmes positions que les raies colorées de son spectre d'émission. L'analyse de ces raies permet donc d'identifier la composition chimique du gaz traversé par la lumière.
Application en astrophysique
Le spectre de la lumière du Soleil, par exemple, n'est pas un spectre continu parfait, mais un spectre d'absorption. Il est parsemé de multiples raies noires, appelées raies de Fraunhofer, causées par l'absorption de certaines longueurs d'onde par les éléments chimiques présents dans l'atmosphère solaire (chromosphère et photosphère) et l'atmosphère terrestre.
L'analyse précise de ces raies de Fraunhofer est un puissant outil d'analyse en astrophysique qui a permis de déterminer la présence de fer (Fe), d'hydrogène (H), de magnésium (Mg), de sodium (Na), et d'ions calcium (Ca+) dans l'atmosphère du Soleil.
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour et merci bien
Bonjour
Comment savoir à partir d’un graphique si le spectre correspond à une lumière polychromatique ou monochromatique?
Merci d’avance
J’ai adoré c’était passionnant.
Quelles sont les meilleures conditions atmosphériques en télédétection utilisant la partie invisible du spectre
Merci beaucoup les cours sont claire !
bonjour,
tout est bien, merci!
Bonsoir, je ne suis qu’en 2nde, je débute donc les spectres d’émissions ect… Il ya quelque chose que je ne comprends pas, on est pas arrivé au point « des spectres d’absorption » mais j’ai une question de type « existe t-il des atomes possédant des raies d’émissions d’intensité tellement faibles qu’elles nous semblent invisibles? Si oui, lesquels ? ». Et après avoir lu plusieurs articles, je penses que la question parle des spectres d’absorption sont issus de ces atomes, mais je ne sais pas. De plus, mon prof nous donne un logiciel qui ne fonctionne même pas comme en cours, alors difficile d’y travailler. S’y quelqu’un pouvait m’éclaircir les idées.
Bonne soirée
Bon résumé sur la spectro d’ émission et d’absorption 👍👍👍