Chapitres
- 01. Définition de l'oxydo-réduction
- 02. Fonctionnement de l'oxydo-réduction
- 03. Ecriture
- 04. Protocole
- 05. Observation
- 06. Analyse
- 07. Demi-pile de référence
- 08. Exercice d'application

Définition de l'oxydo-réduction
Le réducteur cède des électrons : il subit une oxydation. L’oxydant capte des électrons : il subit une réduction. Il faut parvenir à mémoriser correctement ces définitions. On propose un moyen mnémotechnique : Le Réducteur Rend des électrons. L’Oxydant en Obtient. 
Les demi-équations
Puisque dans une réaction d'oxydo-réduction, le réducteur s'oxyde, c'est la réaction d'oxydation et l'oxydant se réduit, c'est la réaction de réduction, l'oxydoréduction se compose donc de deux demi-réactions : une oxydation et une réduction. Elles se présentent sous la forme suivante :
- Oxydation
- réducteur(1) = oxydant(1) + n e-
- Réduction
- oxydant(2) + n e- = réducteur(2)
- Oxydoréduction qui représente donc la "somme" de l'oxydation et de la réduction
- oxydant(2) + réducteur(1) → oxydant(1) + réducteur(2)
Notons que dans les demi-équation, les flèches n'apparaissent que si la réaction est totale, c'est à dire quand K > 10 000
Le potentiel d'oxydo-réduction
Le caractère oxydant ou réducteur d'une espèce dépend de la réaction chimique et des espèces qui interagissent entre elles. En effet, l'élément réducteur dans une réaction peut devenir l'oxydant d'une autre réaction. C'est pour cela que l'on construit une échelle de force oxydante (ou de force réductrice selon le sens donné à cette échelle) afin d'obtenir le potentiel d'oxydo-réduction se mesurant en volt. En outre, le potentiel d'oxydo-réduction dépend du contexte chimique, notamment du pH, mais aussi du contexte physique puisque les effets de la lumière peuvent intervenir dans la nature comme ce qui est le cas avec la photosynthèse chez les plantes ou la photographie avec l'Homme.
Fonctionnement de l'oxydo-réduction
Les réactions d'oxydo-réduction forment une grande famille puisqu'elles comprennent de nombreuses réactions chimiques. En effet, elles interviennent dans les combustions, certains dosages métallurgique mais également la corrosion des métaux, l'électrochimie et la respiration cellulaire. Ce réactions sont alors essentielles puisqu'elles jouent un rôle fondamental en biologie : elles permettent la transformation de l'oxygène en eau, de formule H2O, au sein des organismes vivants. Elles sont également massivement utilisées dans l'industrie humaine, notamment afin d'obtenir de la fonte à partir de différents minerais composés d'oxyde de fer grâce à une réduction, puis de fer et d'acier à partir de la fonte grâce à une réaction d'oxydation.
Ecriture
Le potentiel standard d’oxydoréduction est une grandeur exprimée en Volts (V) associée à un couple rédox. Il permet de situer le couple sur une échelle des couples rédox. Par convention, on le verra, le couple H+/H2 est associé au potentiel V H+/H 2 = 0 V. Petit rappel de physique chimie : Pour ceux qui n’ont jamais réussi à comprendre la différence entre tension et intensité, on propose ici un schéma qui permet d’établir que la tension est bien une différence entre deux potentiels. La tension peut en effet être assimilée à la hauteur de la chute d’eau, qui est égale à la différence entre les altitudes (potentiels) de départ et d’arrivée. Cette tension est à distinguer de l’intensité qui peut être assimilée au débit de la chute d’eau qui ne dépend pas de la hauteur de la cascade mais seulement de la quantité d’eau disponible en amont de la cascade. 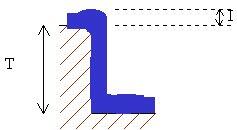
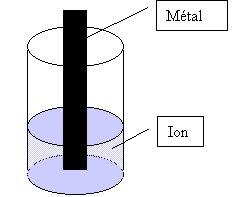
Protocole

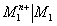
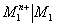
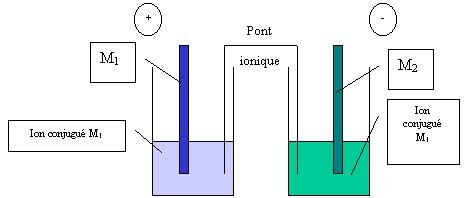
Observation
On observe qu’une tension se crée entre les deux électrodes, ce même si l’on place un voltmètre parfait ( c’est à dire sans résistance interne) entre les deux plaques métalliques. On en déduit qu’il existe une tension à vide entre les bornes de cette pile. On l’appelle aussi f.é.m. pour force électromotrice, notée e. On établit la relation e = VM2-VM1. Dans ce cas, on a e positive. (la f.e.m. est une grandeur toujours positive ) La pile ainsi formée est un générateur de tension. La borne + se trouve sur la plaque métallique correspondant à l’oxydant le plus fort. A l’inverse, c’est la plaque métallique constituée par le réducteur le plus fort qui constitue l’électrode -. On constate donc une diminution de la masse de la plaque métallique constituant l’anode, c’est à dire celle du couple ayant le plus fort réducteur. A l’inverse, il y a disparition des ions dans la solution de la demi-pile correspondant à la borne +.
Analyse
On appelle anode l’électrode par laquelle le courant entre dans la pile. Il s’agit donc de la borne -, celle où se produit l’oxydation. En effet, le courant est un transfert d’électrons. On rappelle que par convention, le courant est orienté dans le sens contraire de celui des électrons. Lorsqu’il entre dans une borne, il y a donc sortie massive d’électrons. Ceux-ci doivent être libérés. On rappelle que la définition de l’oxydation est justement une perte d’électrons (puisque c’est le réducteur qui subit l’oxydation et que ce dernier libère des électrons). Il y a bien oxydation sur l’anode. 
On utilise ce type de bains dans l'industrie pour la fabrication de pièces spéciales ou bien dans le cadre privé afin de nettoyer des bijoux par exemple.
- la concentration des solutions ioniques ( dans lesquelles se trouvent les oxydants des deux couples)
- le pH des solutions ( parce que l’ion H+ peut jouer un rôle d’oxydant).
- la température
On définit donc des conditions standards qui permettent de rendre les observations comparables :
- concentration molaire des solutions ioniques : 1 mol.L-1.
- Pression des gaz : 1 bar (on utilise la pression des gaz parce que certains réducteurs sont gazeux. C’est le cas pour H2.)
- La température est choisie arbitrairement.
Demi-pile de référence
L’électrode standard à hydrogène (E.S.H.) est une électrode virtuelle en platine, plongée dans une solution de pH=0 et entourée de dihydrogène gazeux à la pression 1 bar. Elle réalise donc toutes les conditions standard, d’où son appellation de standard. 
Demi-pile de référence secondaire
On utilise des demi-piles de référence secondaires dont on connaît le potentiel d’oxydoréduction pour déterminer les potentiels standards d’autres couples. En reprenant le schéma de la cascade présenté plus haut, on comprend bien que la détermination est possible dès lors que l’on connaît la tension entre la demi-pile du couple testé et celle de référence secondaire ( c’est à dire leur différence d’altitude) dès lors que l’on connaît le potentiel de la demi-pile de référence secondaire ( son altitude sachant que celle du coupleH+/H2 est 0). En réalité, on peut utiliser une sorte de relation de Chasles pour déterminer le potentiel d’un couple à partir de celui d’un couple connu et de la f.é.m. d’une pile les réunissant. On retient la demi-pile de référence faisant intervenir le couple Cu2+/Cu dont on connaît le potentiel ; : 0, 34 V. Le potentiel standard du couple Mn+/M se note de la façon suivante : 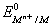
- Les définitions de anode, cathode, réducteur, oxydant, oxydation, réduction ;
- Leur répartition entre les deux demi-pile ;
- La définition du potentiel standard et son utilisation.
Exercice d'application
Lorsque l'on souhaite fabriquer du cuivre métallique, on obtient tout d'abord ce qu'on appelle du cuivre noir ou encore blister qui peut contenir entre 98 et 99,5% de cuivre. Cependant, afin d'être utilisable dans l'industrie électrique, il est essentiel que le cuivre soit pur à 99,9%. C'est pour cela que l'on doit procéder au raffinage du blister via le processus d'électrolyse à anode soluble. Afin d'obtenir des anodes d'électrolyseur, on décide de couler le blister en feuilles de 350 kg, 1 m² de surface et de 3 à 50 mm d'épaisseur. Les cathodes qui sont formées à partir de cuivre raffiné étaient initialement minces et de masse égale à 8 kg. Pour l'électrolyse, on utilise un bain constitué d'une solution de sulfate de cuivre et d'acide sulfurique (Cu2+(aq) : 45 g.L-1 ; H2SO4 : 185 g.L-1). L'électrolyse sera réalisée à une température de 65+C et sous une tension comprise entre 0,2 et 0,3 V durant 21 à 28 jours. On obtiendra grâce à ce processus deux cathodes de 140 à 10 kg avec une teneur minimale de 99,9% de cuivre comme recherché. Ainsi, pour une consommation électique de 250 kWh par tonne de cuivre, on produit 600 tonnes de cuivre par jour en utilisant 1 092 cuves d'électrolyse contenant chacune 46 anodes.
- Calcule la concentration molaire volumique des ions cuivres II contenus dans le bain électrolytique.
- Schématise l'électrolyse en veillant à faire apparaître le sens du courant électrique mais également le sens de déplacement et la nature des porteurs de charge.
- Pour chaque électrode, écrit la réaction ne faisant intervenir que le couple Cu2+(aq)/Cu(s). Pouvez-vous en déduire la position de l'anode et la cathode ?
- Pourquoi peut-on utiliser le terme d'anode soluble ?
- Quelle est la réaction de l'électrolyse ?
- Est-ce que la concentration en ions cuivre II varie au cours de l'électrolyse ? Pourquoi ?
Résumer avec l'IA :






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
C’est bon application
C’est bon de sepulique
C’est génial, mais besoin de corriger beaucoup plus et plus d’épreuve.