Chapitres
- 01. L'électrolyse
- 02. Les électrodes
- 03. Couples rédox de l'eau
- 04. Les accumulateurs
- 05. Le courant électrique
- 06. L'intensité du courant

L'électrolyse
Un peu d'histoire
C'est en 1800 que la toute première électrolyse a été réalisée par deux chimistes originaires de Londres, William Nicholson et Sir Anthony Carlisle. Ils réalisent une électrolyse de l'eau. L'électrolyse met en jeu deux couples rédox. Il les fait réagir dan le sens contraire de la réaction naturelle au moyen d'un courant électrique qui apporte l'énergie nécessaire à la réaction. Un électrolyseur est un dispositif consistant en une récipient contenant une solution ionique dans la quelle plongent deux électrodes.
Définition d'une électrolyse
Une électrolyse est une opération chimique dont le but est de décomposer différentes matières. Par exemple, lorsqu'une solution contient une matière, on va y ajouter un solvant afin que ses ions soit décomposables. On plonge alors ce mélange dans un bain auquel sont intégrés une anode et une cathode, faisant alors passer un courant dans le bain.
Les électrodes
Les électrodes se polarisent dès que le courant passe :
- L'anode est l'électrode par laquelle le courant arrive dans le système. Les électrons en sortent donc. Il y a oxydation du réducteur. Elle est reliée au pôle + du générateur.
- La cathode est l'électrode par laquelle sort le courant c'est à dire par laquelle entrent les électrons. Il s'y produit. Elle est reliée au pôle - du générateur.
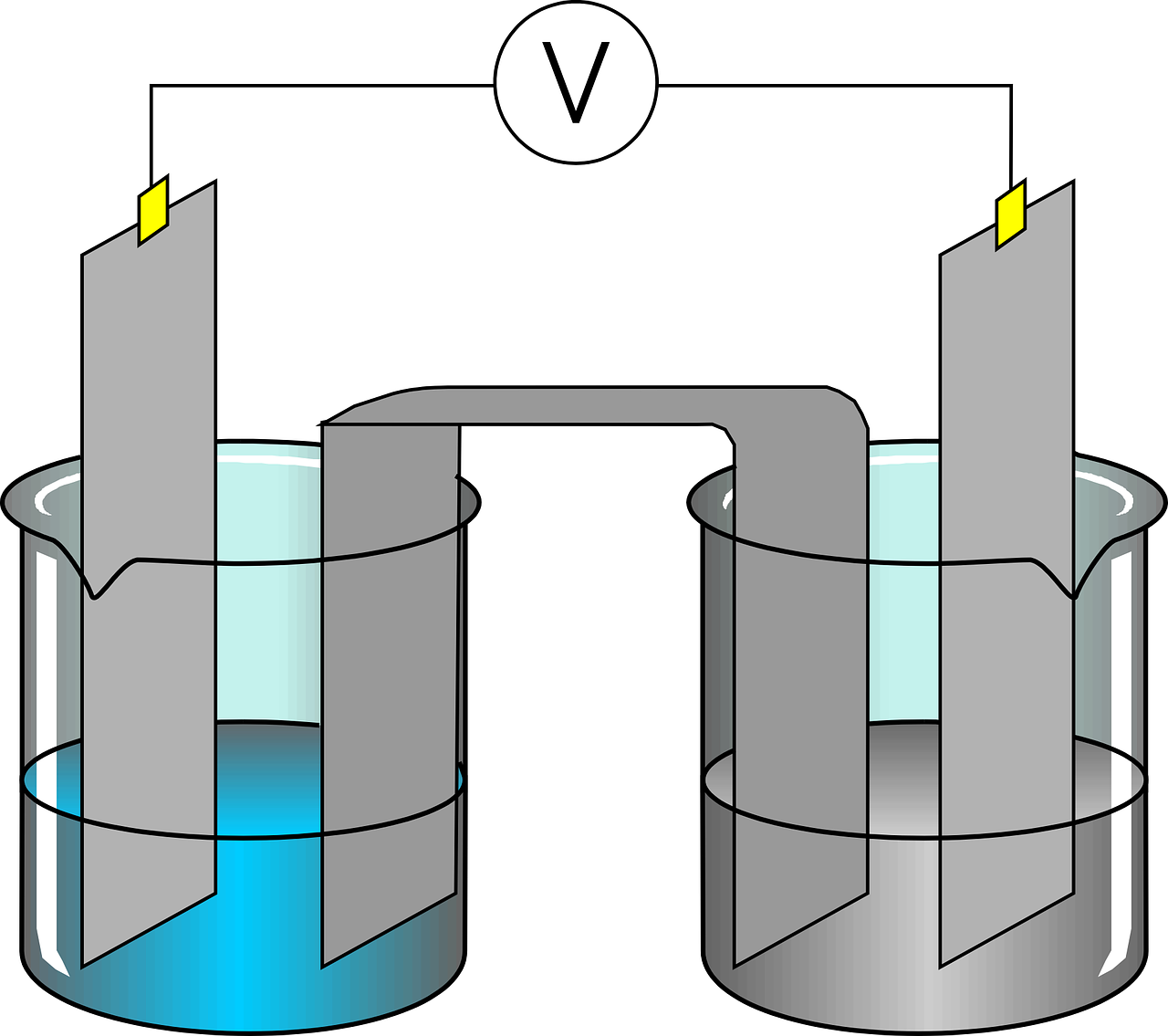
- les ions positifs ou négatifs du bain électrolytique
- les molécules du solvant
- les matériaux constituant les électrodes
Couples rédox de l'eau
H2O peut subir une réduction à la cathode d'un électrolyseur.
- En milieu acide, le couple mis en jeu est H+/H2O selon l'équation suivante : 2 H+ + 2 e- → H 2
- En milieu basique, le couple mis en jeu est H2O/H2 selon l'équation suivante : 2 H2 O + 2 e- → H2 + 2 O H-
H2O peut subir une oxydation à l'anode de l'électrolyseur :
- en milieu acide, le couple rédox mis en jeu est : O2/H2O selon l'équation suivante : H2 O →1/2 O2 + 2 H+ + 2 e-
- en milieu basique, le couple mis en jeu est : O2/OH- selon l'équation suivante : 2 O H-→ 1/2 O2 + 2 H2 O + 2 e
Même si plusieurs espèces ioniques de chaque signe sont présentes dans la solution,
- l'oxydant ayant le plus fort potentiel rédox est réduit à la cathode.
- Le réducteur ayant le potentiel rédox le plus faible est oxydé à l'anode
On a donc une réaction qui est inverse à la règle du gamma. Pour ce, il faut fournir une f.e.m. pour contrer celle qui se manifeste naturellement. En effet, les réactions de l'électrolyse allant dans le sens opposé au sens naturel, ses produits sont précisément les réactifs de la réaction naturelle. Il faut fournir une tension qui empêche cette dernière d'avoir lieu. En effet, au fur et à mesure de la formation des produits par l'électrolyse, la réaction naturelle tend à les détruire et à créer une tension inverse à celle fournie. Il convient donc de l'éviter en fournissant une tension suffisante. 
- les potentiels standards rédox utilisés dans les calculs sont différents des potentiels effectifs parce que l'expérience n'est pas réalisée dans les conditions standard.
- La vitesse de certaines réactions chimiques d'oxydation ou de réduction notamment lors de dégagement gazeux est lente au niveau des électrodes. Il faut alors un apport d'énergie supplémentaire ou surtension.
Les accumulateurs
Un accumulateur est un dispositif électrochimique qui peut fonctionner comme :
- un récepteur électrochimique lorsqu'il joue le rôle d'un électrolyseur. Il se charge grâce à l'énergie électrique apportée par un autre générateur.
- un générateur électrochimique lorsqu'il fonctionne comme une pile simple ( c'est à dire dans le sens naturel de l'oxydoréduction ) : il se décharge.
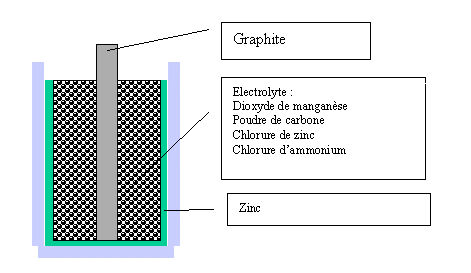
Exemple d'un accumulateur-type : la pile Leclanché Elle se compose :
- d'une anode en zinc conducteur
- d'une solution gélifiée de chlorure de zinc et de chlorure d'ammonium
- d'une cathode constituée d'un bâton de graphite poreux entouré de dioxyde de manganèse, un oxydant non conducteur.

- préciser le coupe rédox mis en jeu et écrire la demi-équation électronique correspondante.
- En déduire s'il y a formation ou disparition de matière aux électrodes
- Exprimer la relation entre quantité d'électricité Q qui circule et la quantité d'électrons échangés.
- A l'aide de l'équation-bilan, déduire de ce qui précède la relation entre quantité de matière formée ou passée en solution, et quantité d'électricité qui circule.
Les difficultés de la leçon
- toujours bien connaître les concepts
- bien, identifier les couples et les réactifs mis en jeu dans l'électrolyse.
- prendre en compte les valeurs ALGEBRIQUES dans le calcul des f.e.m.
- bien distinguer les deux phases de l'accumulateur : charge ( identique à l'électrolyse) et décharge ( assimilée à la réaction rédox classique)
Le courant électrique
Histoire du courant
L'électricité est un phénomène naturel qui a commencé a être étudié dès le 16 ème siècle. L'arrivée du courant alternatif date de 1882 en France par l'invention de l'ingénieur Lucien Gaulard : le transformateur. Cela créa une véritable révolution dans l'industrie de distribution d'électricité. Comme le courant alternatif présentait plus d'avantages, il a rapidement remplacé le courant continu.
Un transformateur est un appareil censé modifier la tension et l'intensité d'un courant délivré par une source d'énergie alternative sans en changer la fréquence ou la forme.
L'intensité du courant
L'intensité d'un courant électrique correspond à une des nombreuses grandeurs mesurables au sein des circuits électriques. Cette mesure permet alors de connaître le débit des charges électriques à travers une section du circuit étudié. L'intensité du courant électrique possède comme unité l'ampère qui est noté A. Cette unité tient son nom du célèbre physicien français André-Marie Ampère qui travaillera longuement et produira de nombreux travaux en rapport avec l'électricité.
L'intensité du courant électrique est la même dans tous les dipôles d'un circuit en série : c'est la loi d'unicité de l'intensité dans un circuit série.
L'intensité I du courant qui circule dans la branche principale est égale à la somme des intensités I1 et I2 qui circule dans les branches dérivées :
I = I1 + I2
Cette relation constitue la loi d'additivité des intensités des courants.

Résumer avec l'IA :























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
très bonne article mais manque de précisions , sur les très basse tension pour l’électrolyse
J’aime ces découvertes